유치 및 영구치에서 QLF를 이용한 항우식 제품의 재광화 효과 비교
Evaluation of Remineralization Effects on Enamel Demineralization by Anti-cariogenic Agents using Quantitative Light-induced Fluorescence-digital (QLF-D) in vitro
Article information
Abstract
본 연구의 목적은 quantitative light-induced fluorescence-digital(QLF-D) 시스템을 이용하여 유치와 영구치에 형성된 탈회된 법랑질에 서로 다른 세 종류의 항우식 제품 적용 후 각각의 재광화 효과를 비교하는 데 있다. 연구를 위해 각 48개의 건전한 유치 및 영구치를 대상으로 대조군(1군), 불소 함유 치약(2군), functionalized tricalcium phosphate(fTCP) + 불소 함유 치약(3군), casein phosphopeptide-amorphous calcium phosphate(CPP-ACP) 함유 치아 크림(4군)으로 무작위 분류하였다. 유치 및 영구치에 법랑질 탈회를 유발한 후, 14일 동안 1일 2회 항우식 제품을 처리하였으며, quantitative light-induced fluorescence(QLF)를 이용하여 재광화 효과를 비교 분석하였다. 연구 결과, 세 종류의 항우식 제품 모두 유치와 영구치에서 대조군인 1군에 비해 우식 병소의 무기질 소실량을 유의하게 감소시켰으며, 치약 제품 간 비교에서는 3군과 4군에서 2군에 비해 유의하게 높은 재광화 효과를 나타냈다. 이를 통하여 fTCP와 불소 함유 치약 및 CPP-ACP 함유 치아 크림이 유치와 영구치 모두에서 우수한 재광화 효과를 보인다는 것과, QLF-D가 초기 우식 병소와 항우식 제제의 재광화 효과를 정량적으로 평가함에 있어 유용한 장비임을 알 수 있다. 그러므로 임상가들은 유치와 영구치에서의 탈회 및 재광화 평가 시 QLF-D 시스템의 임상적 적용을 고려할 수 있을 것이다.
Trans Abstract
The purpose of this study was to evaluate the difference of remineralization effects of various anti-cariogenic toothpastes on artificial carious lesions in primary and permanent teeth using quantitative light-induced fluorescence- digital (QLF-D) system. Sound human primary (n = 48) and permanent teeth (n = 48) were randomly divided into following groups : control group (Group 1), fluoride toothpaste (Group 2), functionalized tricalcium phosphate (fTCP) + fluoride toothpaste (Group 3), and casein phosphopeptide-amorphous calcium phosphate (CPP-ACP) toothpaste (Group 4). Specimens were prepared by exposure in a demineralizing solution and then treated using the different toothpastes twice daily during 14 days. All specimens were analyzed with the QLF-D system. QLF data analysis indicated three different toothpastes showed significant remineralizing effects compared to Group 1 in both primary and permanent teeth. Also, the remineralizing effects in Group 3 and 4 were significantly higher than in Group 2. This study suggested that the toothpastes containing fTCP + fluoride and CPP-ACP have the significant anti-cariogenic effects on enamel demineralization in both primary and permanent teeth, and QLF-D is an useful device to assess the incipient carious lesion and remineralization effects of the anti-cariogenic materials quantitatively. Therefore, clinicians can consider the QLF-D system for the evaluation of demineralization and remineralization in primary and permanent teeth.
Ⅰ. 서 론
법랑질 탈회는 치태 내 우식 유발 세균들이 생산하는 산에 의해 칼슘, 인, 수산화기 결정이 용해되는 것으로, 교정 치료 중인 환자나 구강 위생이 불량한 환자들에서 흔히 관찰된다[1]. 임상적으로, 탈회에 의한 초기 법랑질 우식 병소는 와동이 형성되기 전 단계인“백색 반점(white spot)”으로 관찰되며, 불소 도포 등의 예방적 술식에 의해 재광화(remineralization)가 가능하다고 여겨진다[2].
그러나 이러한 백색 반점은 임상 검사 시 간과되기 쉬우며, 중성 환경 조성과 상실된 무기질 공급을 통한 재광화 과정이 지속되지 않는다면 와동을 형성하는 깊은 우식으로 발전할 수 있다[3]. 때문에, 초기 병소의 조기 발견 및 적절한 예방적 처치를 통한 재광화 유도가 매우 중요하다.
현재 초기 우식증의 재광화 및 우식증의 예방을 위해 사용되는 가장 대표적인 제제는 불소이다[3]. 그러나 불소는 과다 섭취 시 오심, 구토 등 독성 발생 위험이 있어 보다 안전하며 효율적인 재광화 제제에 대한 요구가 높아지고 있다[4]. 불소 이외에도 초기 우식의 재광화를 위한 제제로 주목 받고 있는 casein phosphopeptide-amorphous calcium phosphate(CPP-ACP)는 우유 단백질 casein에서 추출된 성분으로, CPP와 ACP의 결합을 통해 칼슘인산이온을 안정화시킨 형태이다[5,6]. CPP-ACP는 치태 및 치면에 부착되어 칼슘과 인산 이온의 저장소로 작용하며, 산성 환경에서 칼슘과 인산 이온을 방출하여 치아 표면을 무기질 과포화 상태로 만듦으로써 탈회 억제 및 재광화 촉진 효과를 보인다[6].
다른 연구에서는 tricalcium phosphate(TCP)와 불소 존재 시 침식된 법랑질의 재광화를 촉진시킬 수 있음을 보고하였다[7]. 그러나 TCP는 불소가 존재하는 환경에서 쉽게 불화 칼슘을 형성하여 재광화에 필요한 무기질 이온 농도를 낮출 수 있다는 한계를 지닌다[8]. 이에 라우릴 황산 나트륨(sodium lauryl sulphate)으로 TCP 입자를 코팅하여 불소와의 반응성을 낮추고 기능적으로 안정화된 fTCP(functionalized β-TCP)를 이용한 재광화 제제가 개발되었다[9].
이와 같은 재광화 제제 적용을 위해 무엇보다 중요한 것은 초기 우식 병소의 조기 발견이다. 간과하기 쉬운 초기 우식증의 조기 진단을 위하여 최근 quantitative light-induced fluorescence(QLF)가 진단 장비로 널리 사용되고 있다[10]. QLF는 405 nm 파장 영역의 빛을 조사하였을 때 건전 법랑질과 탈회 법랑질 사이에 나타나는 빛 투과성 차이를 이용하여 비침습적으로 초기 우식증의 진단 및 탈회 정도의 정량적 분석을 가능하게 한다[10,11]. QLF-D(QLF-digital)는 특수 광원과 필터가 내장된 디지털 카메라를 활용하여 일반 백색광원 영상과 QLF 형광 영상을 연속으로 촬영할 수 있도록 개발된 제품으로, QLF의 임상적 활용을 더욱 용이하게 하였다[12].
한편, 유치와 영구치 법랑질은 그 조성 및 구조에서 여러 차이를 보인다. 즉, 유치는 무기질 함량이 낮아 영구치에 비해 높은 수분 및 유기질 함량을 보이며, 영구치보다 법랑질 두께가 얇고, 법랑질 최외층에서 법랑소주의 구조가 나타나지 않는 무소주(prismless) 법랑질 층이 보다 빈번하게 관찰된다[13,14]. 이에 근거하여 여러 연구들에서는 유치와 영구치에서 산부식 저항성 및 치아 부식에 대한 민감도 등의 차이를 보고한 바 있다[13,15]. 그러나 유치와 영구치에서 불소를 비롯한 재광화 제제의 효과를 비교한 이전 연구들에서는 일관된 결과가 관찰되지 않았으며, QLF를 이용하여 이를 비교한 연구는 부족한 실정이다[16,17].
이에 본 연구에서는 QLF-D 장비를 이용하여 유치와 영구치에서 다양한 항우식 제품의 재광화 효과를 정량적으로 평가하고자 하였다.
Ⅱ. 연구 재료 및 방법
1. 연구 재료
본 연구는 이화여대 부속 목동병원 기관윤리위원회로부터의 승인을 거쳐 진행되었다(승인번호 2015-04-027). 실험에 사용된 치아는 발치를 주소로 내원한 환자들에서 환자 또는 환자 보호자의 동의를 받아 최근에 발거된 치아로서, 치아 우식증이나 변색, 수복물 등이 없는 건전한 유치 48개와 영구치 48개를 대상으로 하였다. 수집된 치아는 주변의 이물질을 제거하고 초음파 세척한 후 4℃ 생리 식염수에 보관하였다.
2. 연구 방법
1) 시편 제작
치면을 세척 및 건조한 후 협설면이 노출되도록 하여 퍼티(ExaFlex Putty; GC Co., Alsip, IL, USA) 블록에 매몰 및 고정하고, 유치에서 2 × 2 mm2, 영구치에서 3 × 3 mm2 영역을 제외한 모든 면을 투명한 네일 바니쉬(Max Factor®; Procter & Gamble Ltd, Surrey, UK)로 2회 도포하여 코팅되도록 하였다.
2) 법랑질 탈회 유발
법랑질 탈회를 위해 치아 시편을 37℃ 탈회 용액에 5분 간 담근 후 수세 및 건조하였다. 탈회 용액은 3-5% hydrochloric acid 와 95-97% nonhazardous proprietary components (acid chlorides, phosphorus trichloride, phosphorus pentachloride, phosphorus oxychloride)로 구성된 Calci-Clear Rapid(National Diagnostics, Atlanta, GA, USA) 용액을 증류수와 1:1로 희석하여 제작하였다. 법랑질 탈회가 형성된 치아 시편은 Taliva®(Hanlim Pharm, Seoul, Korea) 인공 타액에 넣어 상온에서 보관하였다.
3) 항우식 제제의 적용
유치(n=48) 및 영구치(n=48) 치아 시편을 무작위로 12개 씩 각각 4군으로 다음과 같이 분류하였으며, 사용된 제품의 특성은 Table 1과 같다.
1군 : 대조군(무처치군)
2군 : 불소 함유 치약 처리군(2080 kids 또는 original toothpaste)
3군 : fTCP + 불소 함유 치약을 처리한 군(Clinpro™ Tooth Créme)
4군 : CPP-ACP 함유 치아 크림을 처리한 군(Tooth Mousse®)
1군은 대조군으로 1일 2회 3분간 탈회 치면을 증류수로 닦은 후 인공 타액에 보관하였다. 2군은 아동용 또는 성인용 불소 함유 치약을 이용하여 1일 2회 3분간 칫솔질 후 세척하여 인공 타액에 보관하였다. 3군은 fTCP와 불소 함유 치약(Clinpro™ Tooth Créme, GC Co., Tokyo, Japan)을 이용하여 1일 2회 3분간 칫솔질 후 제조사의 지시에 따라 세척하지 않고 인공 타액에 보관하였다. 4군은 CPP-ACP 함유 치아 크림(Tooth Mousse®, 3M ESPE, St. Paul, MN, USA)을 면봉에 묻혀 1일 2회 3분간 탈회 치면에 적용 후 제조사의 지시에 따라 세척하지 않고 인공 타액에 보관하였다. 모든 실험은 동일한 한 명의 실험자가 동일한 시간에 시행하였으며, 인공 타액은 24시간마다 교환하였다.
4) QLF 측정
Digital full-sensor SLR camera(Model 550D, Canon, Tokyo, Japan)에 청색광과 백색광의 LED가 카메라 본체 앞에 장착된 QLF-D system(BiluminatorTM, Inspektor research systems BV, Amsterdam, The Netherlands)을 사용하여, 암실에서 법랑질 탈회 병소의 ΔQ(형광소실도%, mm2)를 측정하였다. 촬영 전 치아 시편을 증류수로 수 회 세척 및 30초간 압축 공기로 충분히 건조시킨 후 일정한 거리에서 촬영을 시행하였다. 측정은 숙달된 1인 조사자에 의해 동일한 환경에서 시행되었으며, 측정 시점은 시편에 탈회 형성 전, 탈회 형성 직후(baseline), 항우식 제품 적용 후 3일, 7일, 14일 째 측정하였다. 각 치아마다 탈회 용액에 의해 형성되는 탈회의 정도가 다를 수 있으므로, 평균 ΔQ와 심한 차이를 보이는 시편은 실험에서 제외하였다.
3. 통계처리
통계 처리를 위하여 SPSS 20.0(SPSS, Chicago, IL, USA) 통계 프로그램을 이용하였다. 각 군에서 시간에 따른 변화의 차이를 알아보기 위하여 Wilcoxon-Signed Rank test를 이용하였으며, 군 간 유의성 차이를 비교하기 위하여 Kruskal-Wallis test와 Mann-Whitney test를 이용하였다. 통계 분석의 유의수준은 p < 0.05로 하였다.
Ⅲ. 연구 성적
1. 항우식 제품 처리 기간에 따른 재광화 효과
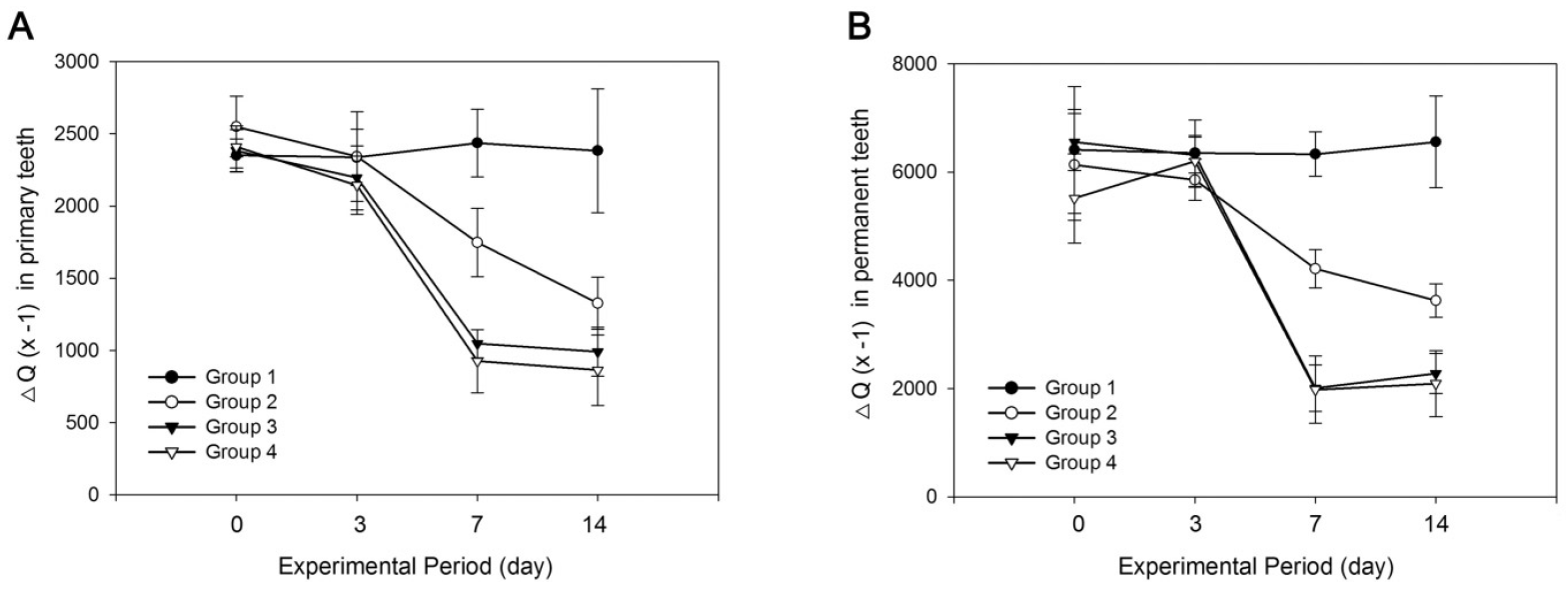
유치와 영구치의 법랑질 탈회 병소에 항우식 제품 처리 후 QLF-D를 이용하여 무기질 소실량(ΔQ)의 변화를 측정하였다(Fig. 1, Table 2, 3). 서로 다른 3 종류의 항우식 제제를 처리한 후 각각 3일, 7일, 14일 째 ΔQ를 측정한 결과, 유치와 영구치 모두에서 시간에 따른 무기질 소실량의 감소를 관찰할 수 있었다(Fig. 1). 항우식 제품 적용 3일, 7일, 14일 경과 후 ΔQ의 변화량(ΔΔQ)을 관찰한 결과, 3일 동안의 ΔΔQ 와 비교할 때 유치와 영구치 모두에서 항우식 제품 적용 7일과 14일 후 ΔQ의 감소가 유의하게 컸다(Table 2, 3). 또한 유치의 2군에서는 14일 동안 ΔQ 변화량이 48%로 7일 동안의 31%와 비교할 때 유의하게 컸으나, 3군, 4군에서는 7일 이후 14일까지 ΔΔQ의 변화가 적었다(Table 2). 영구치에서는 2군에서 14일 동안 ΔQ 변화량이 41%로 7일 동안의 31% 보다 유의하게 컸으나, 3군, 4군에서는 7일과 14일 동안 ΔQ의 변화량이 유의한 차이를 보이지 않았다(Table 3). 세 종류의 항우식 제품 적용 후 14일째에는 유치와 영구치 모두에서 처리 전과 비교하여 무기질 소실량이 약 40% 이상 크게 감소하였다(Fig. 2).

Representative images of the experimental groups, QLF-D (quantitative light-induced fluorescence-digital) images after exposure in a demineralizing solution in primary tooth (A) and permanent tooth (C), and after application of anti-cariogenic toothpaste for 14 days in primary tooth (B) and permanent tooth (D).
2. 항우식 제품별 재광화 효과
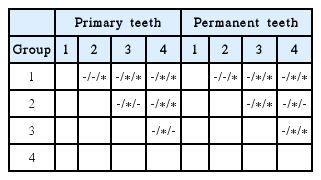
서로 다른 3 종류의 항우식 제제를 처리한 후 아무 것도 처리하지 않은 1군과 비교하여 ΔQ의 변화량을 관찰하였다(Table 4). 유치와 영구치 모두에서 대조군인 1군과 비교 시 2군은 14일 후부터, 3군, 4군은 7일 후부터 무기질 소실량의 유의한 차이를 보였다. 불소 함유 치약을 처리한 2군과 비교 시, 3군과 4군에서 7일 동안 무기질 소실량의 변화가 더 크게 관찰되었다. 영구치에서는 3군과 4군에서 7일, 14일째 무기질 소실량의 변화가 유의한 차이를 보인 반면, 유치에서는 7일째에만 유의한 차이를 보였다.
3. 유치와 영구치에서의 재광화 효과
유치와 영구치에서 각 제품군별 무기질 감소 효과를 비교한 결과(Fig. 3), 2군에서는 14일 째 유치에서 영구치보다 재광화 효과가 유의하게 컸다. 이와 달리 3군에서는 7일 후부터 영구치에서 보다 큰 재광화 효과를 보였다. 4군에서는 3일 째 외에 유치와 영구치에서 재광화 효과의 차이를 보이지 않았다. 항우식 제품 처리 14일 후 처리 전과 비교하여 무기질 소실량의 총 변화를 살펴보면, 2군에서는 유치에서 무기질 소실량이 약 48% 감소하여 영구치의 41%보다 감소량이 컸으며, 3군에서는 유치에서 약 58%, 영구치에서 약 65%로 영구치에서 보다 큰 무기질 소실량의 감소를 보였다. 반면 4군에서는 유치와 영구치에서 유의한 차이를 보이지 않았다.
4. 항우식 제품 종류 및 처리 기간에 따른 재광화 속도
항우식 제품 종류 및 처리 기간에 따른 재광화 속도를 비교하기 위하여 1일간 평균 ΔΔQ%를 분석하였다(Table 5, 6). 그 결과, 유치와 영구치의 2군, 3군, 4군 모두 3-7일 사이에 재광화 속도가 가장 빠르게 관찰되었으며, 7-14일의 재광화 속도와 통계적으로 유의한 차이를 보였다. 3-7일 사이 유치와 영구치 모두에서 2군에 비해 3군, 4군의 재광화 속도가 유의하게 빨랐으며, 3-7일과 7-14일 비교 시 2군에서는 3군, 4군에 비해 재광화 속도의 감소가 비교적 완만하게 나타났다.
Ⅳ. 총괄 및 고찰
최근 질환의 조기 발견 및 예방에 대한 관심이 높아지면서, 백색 반점이라 불리는 초기 치아 우식증의 재광화 치료 또는 최소 침습 치료가 동반되어야 한다는 진료 지침이 일반화되고 있다[18]. 이에 따라 초기 우식증의 진단을 위하여 laser fluorescence(LF), digital imaging fiber-optic trans-illumination(DiFOTI), electronic caries monitor(ECM), QLF 등 가시광선이나 레이저를 이용한 탐지 장비들이 개발되었다[18]. QLF는 푸른색 가시광선에 의해 유도되는 치아의 자가 형광성을 이용하여 무기질이 소실된 부위에서의 형광 소실도를 정량적으로 분석하는 장비로, 초기 우식 병소 탐지 및 무기질 감소량(ΔQ)의 정량화를 가능하게 하였다[19]. QLF는 치질의 탈회 상태와의 상관관계가 0.82-0.92, 특이도는 0.70으로 다른 시스템에 비해 높고 안정된 진단 능력을 보여준다[20]. 또한 표면미세경도 측정법 등과 달리 치아를 절단하지 않고도 탈회 및 재광화에 대한 정량적 분석이 가능하여 그 결과를 바로 임상적으로 적용할 수 있다. 이에 본 연구에서는 유치와 영구치에 서로 다른 세 종류의 항우식 제제 적용 후 QLF-D를 이용하여 법랑질 탈회 병소의 재광화 효과를 살펴보았다.
대표적인 항우식 제제로 가장 흔히 사용되고 있는 불소는 치질의 수산화인회석(hydroxyapatite)과 반응하여 불화인회석(fluorapatitie)을 형성하고, 타액 내 칼슘과 인산 이온을 치아에 침착시켜 탈회 억제 및 재광화 촉진 효과를 나타낸다[21]. 불소치약 내 불소 함유량은 500-1,500 ppm으로 다양하지만, 학령 전 아동의 경우 치약을 삼키거나 불소증 발생의 우려가 있어 1,000 ppm 미만의 저농도 불소 치약 사용이 권장되고 있으며, 네덜란드나 영국 등 유럽 국가에서는 500-600 ppm의 저불소 치약 사용을 권유하고 있다[22,23]. 국내에서는 어린이 치약의 불소 함량에 대한 적정 기준이 마련되어 있지 않은 실정이나, 국제적 흐름을 참고하여 본 연구에서 역시 500 ppm의 불소가 함유된 어린이 치약을 연구에 이용하였다.
불소 함량 1,000 ppm 미만 저불소 치약의 항우식 효과에 대한 이전 연구들은 서로 다른 결과들을 보고하였다[24-28]. 그러나 많은 연구에서 500-600 ppm의 불소 치약 사용 시 250 ppm의 불소 치약과 달리 1,000 ppm의 불소 치약과 거의 유사한 항우식 효과를 보임을 증명하였다[26-28]. 본 연구에서는 유치에 불소 함유량이 500 ppm인 치약을 적용한 결과, 처리 14일 후 무기질 소실량이 처리 전에 비해 약 48 ± 12% 감소하였다. 이는 영구치에서 1,000 ppm 불소 치약 적용 14일 후 무기질 소실량이 처리 전에 비해 41 ± 20% 감소하였던 것보다 높은 수치였다. 그러나 본 연구에서는 한 치아 군 내에서 불소 농도에 따른 효과 비교를 목적으로 하지 않았기 때문에, 유치에서 고농도 불소 치약 대비 저농도 불소 치약의 효과에 대해서는 더 많은 연구가 필요할 것이다.
불소의 우식예방 및 재광화 효과가 명백함에도 불구하고, 불소 제제 사용 시 불소증 및 과다 섭취로 인한 부작용 발생 가능성 등의 한계점이 존재한다[29]. 이와 달리 우유 단백질의 casein에서 추출한 CPP-ACP는 소아가 삼켜도 인체에 무해하며, 우수한 재광화 효과를 갖는 것으로 알려져 많은 연구가 진행되어 왔다[6,30]. CPP는 인산 칼슘의 phosphoserine 잔기와 ACP를 결합시켜 인산 칼슘을 안정화시키고 이를 통해 미세한 CPP-ACP 집락을 형성한다[31]. 이는 치면에서 인산칼슘이 과포화된 안정한 환경을 조성함으로써 법랑질의 탈회를 억제하고 재광화를 촉진한다[6]. CPP-ACP와 불소의 항우식 효과를 비교한 여러 연구에서는CPP-ACP의 재광화 효과가 불소와 유사하거나 보다 높다고 보고하였다[31-33]. Zhou 등[31]과 Zhang 등[33]의 연구 결과에서처럼 본 연구에서 역시 유치와 영구치 모두에서 CPP-ACP 함유 치아 크림을 적용한 4군이 불소 치약을 적용한 2군보다 높은 재광화 효과를 갖는 것으로 나타났다. 이는 아마도 불소가 병소의 표층만을 불완전하게 재광화시켜 무기질의 심부이동을 오히려 차단할 수 있다는 것과, CPP-ACP가 불소 제제와 달리 타액 내가 아닌 자체적으로 함유한 무기질 이온을 이용한다는 것에 기인한다[3].
fTCP는 가공 및 코팅을 통해 β-TCP를 라우릴 황산 나트륨 또는 푸마르산(fumaric acid)과 같은 유기 또는 무기분자와 결합시켜 기능적으로 안정화시킨 형태이다[8]. TCP는 불소와 반응을 통해 조기에 불화칼슘을 형성함으로써 재광화에 필요한 무기질 이온을 소모시켜 버리지만, fTCP는 TCP를 기능적으로 안정화시킴으로써 산화칼슘과 불소의 불필요한 상호작용을 막고, 치약이나 가글액과 같은 형태로 치아에 적용 가능하게 하였다[9]. 계면활성제의 하나인 라우릴 황산 나트륨과 결합시킨 fTCP는 법랑질과 친화성을 가져 치아 표면에 활발하게 작용하며, 칫솔질 시 코팅이 깨지면서 치아에 풍부한 무기질 이온을 전달하는 역할을 한다[7,8]. Karlinsey과 Pfarrer [9]은 fTCP와 불소를 함께 적용 시 불소 단독 또는 fTCP 단독으로 적용한 경우 보다 훨씬 높은 재광화 유도 효과를 보임을 증명하였다. 이는 fTCP + 불소 함유 치약을 적용한 3군에서 불소 함유 치약을 적용한 2군보다 유의하게 높은 재광화 효과를 보인 본 연구 결과와도 일치한다.
유치와 영구치 법랑질의 분명한 구조적 차이는 이미 여러 연구에서 증명된 바 있다[34-38]. 첫째로, 유치 법랑질은 영구치에 비해 덜 광화되어 있어 영구치 법랑질의 무기물 함량은 97%로 수분과 유기물이 거의 없는 반면, 유치 법랑질의 무기물 함량은 81.3-94.2 wt%로 보다 낮은 값을 보인다[36-38]. 둘째, 유치 법랑질은 영구치 법랑질보다 공극률이 높고 확산계수가 커 탈회에 보다 취약할 수 있는 성질을 가진다[34,35]. 그러나 치아 우식증에 대한 유치와 영구치의 감수성 차이를 조사한 이전 연구들에 의하면, 유치 법랑질이 영구치보다 우식증에 대한 감수성이 더 높다는 연구 결과도 보고되었으나[15,39], 유치와 영구치 사이에 통계적으로 유의한 차이를 보이지 않았다는 연구 결과[40,41]도 있어 상반된 결과를 보였다. 유치와 영구치에서 항우식 제제의 재광화 효과를 비교한 여러 연구들에서 또한 통계적인 차이를 보이지 않았거나, 영구치 또는 유치에서 보다 큰 재광화 효과를 보였다는 서로 다른 결과들이 존재한다[16,17,34,42,43].
본 연구에서는 유치와 영구치에 서로 다른 세 종류의 항우식 제품을 도포한 결과, 14일 후 2군에서는 영구치의 무기질 소실량은 41 ± 20%, 유치의 무기질 소실량은 48 ± 12%만큼 감소하여 유치에서의 재광화 효과가 보다 컸으며, 3군에서는 영구치의 무기질 소실량은 65 ± 10%, 유치의 무기질 소실량은 58 ± 12%만큼 감소하여 영구치에서의 재광화 효과가 유치에서보다 컸다. 4군에서는 처치 3일 후 유치에서 통계적으로 높은 재광화 효과를 보였으나, 이후 7일과 14일째에는 유의한 차이를 보이지 않았다. 이처럼 유치와 영구치에서의 재광화 효과 비교에서 각 군별로 서로 다른 결과가 관찰된 것은 아마도 실험에 이용되었던 유치 및 영구치 시편의 발치 전 구강 내 맹출 기간 및 환경이 완전히 제어되지 못한 상태였기 때문일 수 있다. 치아 시편의 실험 전 환경 제어 문제는 유치와 영구치의 우식 감수성 및 재광화 효과에 대한 이전의 비교 연구들에서 일관된 결론이 도출되지 못하고 있는 원인 중 하나이기도 한데, 구강 내 맹출한 후 치아가 겪게 되는 지속적인 환경 변화가 법랑질 미세 구조의 변화를 일으키며, 이것이 법랑질 투과성에 직접적인 영향을 미치기 때문이다[34]. 법랑질의 투과성 및 이온 또는 분자의 흡수 정도는 법랑질의 형태 및 치령 등에 따라 달라질 수 있는데, 이전 연구에 따르면 미맹출 치아가 맹출 후보다 더 높은 투과성을 보이며, 새롭게 맹출한 치아는 이미 맹출되어 어느 정도 시간이 경과된 치아보다 높은 불소 흡수율을 보였다[34,44]. 본 연구에서는 구강 내 맹출 기간이 비교적 긴 탈락 시기의 유치를 연구에 이용하여 유치와 영구치 법랑질의 구조적 차이가 일부 상쇄되었을 가능성이 있다. 따라서 유치와 영구치에서 재광화 효과의 비교를 위해서는 더 많은 연구가 필요할 것이다. 그럼에도 불구하고 본 연구에서 재광화 제제를 포함한 서로 다른 제품을 적용한 결과, 유치와 영구치 모두에서 비교적 우수한 재광화 효과를 보였으며, 이는 초기 우식 병소에서 항우식 제품의 적용이 유치와 영구치 모두에서 매우 유의할 수 있음을 보여주는 것이다.
본 연구에서는 항우식 제품 적용 3일 혹은 7일 후 유의한 재광화 효과가 관찰되었으며, 재광화 속도를 분석한 결과 3-7일 사이에 가장 빠르게 재광화가 이루어짐을 알 수 있었다. 그러나 이는 인공적으로 우식 병소를 형성한 직후 재광화 제제를 적용하여 나타난 효과로, 임상적으로 존재하는 백색 병소에서의 결과와 차이를 보일 수 있다. 따라서 실제 임상에서 항우식 제품 적용 시 재광화가 관찰되는 시기 및 가속화 시기에 대해서는 더 많은 연구가 필요할 것이다. 또한 본 연구에서 한 명의 실험자에 의해 칫솔을 이용하여 치아 시편에 항우식 치약을 적용하였으나 이는 칫솔질의 횟수 및 강도 등에서 균일성을 확보하기 어려운 한계를 지닌다. 따라서 추후 연구에서는 칫솔질을 위한 왕복 운동 기계를 이용한다면 보다 객관적인 자료를 획득할 수 있을 것이다.
Ⅴ. 결 론
본 연구에서는 유치와 영구치에 서로 다른 종류의 항우식 제품을 적용한 후 QLF-D를 이용하여 탈회 법랑질의 재광화 효과를 알아보고자 하였다. 유치와 영구치에서 서로 다른 세 종류의 제품을 처리한 결과, 세 군 모두에서 3일 혹은 7일 후부터 대조군에 비해 무기질 소실량이 유의하게 감소하였다. 또한 유치와 영구치 모두에서 불소 함유 치약을 처리한 경우보다 fTCP + 불소 함유 치약, CPP-ACP 함유 치아 크림을 처리한 경우 유의하게 높은 재광화 효과가 관찰되었다. 따라서 불소 치약 사용이 제한적인 영유아 및 소아에서 안정성 및 재광화 효과를 고려하여 CPP-ACP 함유 치아 크림 사용을 권장할 수 있으며, 불소 단독 함유 치약보다 fTCP와 불소가 함께 함유된 치약 사용이 보다 효과적일 수 있다. 본 연구를 통해 QLF-D가 유치와 영구치 모두에서 탈회 및 재광화 정도를 정량적으로 분석하는데 매우 유용한 장비임을 알 수 있으며, 임상가들은 초기 우식 병소의 진단 및 항우식 제품의 재광화 효과를 평가함에 있어 QLF-D의 임상적 적용을 고려할 수 있을 것이다.