치아 미백 효과의 장기화를 위한 Resin Infiltration의 활용
Utilization of Resin Infiltration for Prolonging of Tooth Whitening Effects
Article information
Abstract
최근 들어 치아 미백술이 대중화되고 있으나, 단기간내 색소 재침착 등 고유의 한계점이 극복되지는 못 하고 있는 실정이라 할 수 있다. 본 연구는 치아 미백 효과의 색조 안정성을 향상시킬 방법의 하나로서, resin infiltration의 활용 타당성을 평가할 목적으로 시도되었다.
건전한 총 40개 우치 전치 순면으로부터 법랑질 시편을 채취, 제작하여 1차 착색 및 미백술을 시행하였다. 21일 경과후 시편을 무작위로 3개 군으로 나누어, resin infiltration군(RI군) 과 레진 접착제군(RA군)에 각 15개씩, 그리고 나머지 10개를 대조군으로 하였다. 마지막으로 전체 시편에 대하여 2차 착색을 시행하였다. 전 연구과정에서 색조 평가는 최초상태, 착색 직후, 미백제 적용후, 각 재료 적용후 및 2차 착색 후의 총 5회를 시행하였으며, spectrophotometer를 이용하여 측정하고 CIE L*a*b* 색조계로 기록하였다.
모든 군이 착색 후 L* 값은 감소, a*, b* 값은 증가하였으며, RI군과 RI군 모두 재료 적용 전후의 유의한 색조변화는 없었다(p > 0.05). 1차 착색 전후의 색조변화량은 RI군, RA군 및 대조군에서 각각, 12.16 ± 3.50, 12.16 ± 3.38, 15.81 ± 6.39 였던 반면, 2차 착색 전후의 변화량은 각각 15.21±7.19, 15.93±4.31, 그리고 26.62 ± 17.89 로 나타났다. 2차 착색 후의 색조변화량은 RI군과 대조군간에 유의한 차이를 보였다. 또한, 1, 2 차 착색 전후의 각 군내 색조변화량 비교에 있어서는, RA 군과 대조군에 있어서는 유의한 차이를 보였으나(p< 0.05), RI군에서는 차이가 존재하지 않았다(p = 0.26).
이상의 결과로 보아, 재착색에 민감한 미백후의 치아에 대하여 레진 접착제의 적용으로는 미흡하며, resin infiltration을 통하여 색조 안정성을 향상시킬 수 있음을 확인할 수 있었다.
Trans Abstract
The present study aimed to evaluate the validity of resin infiltration in improving color stability after tooth whitening. Enamel samples were extracted from 40 healthy bovine upper incisors, and primary staining and whitening were performed. After that, specimens were randomly divided into 3 groups : resin infiltration group (n = 15, RI group), resin adhesive group (n = 15, RA group), and control group (n = 10). Secondary staining was performed on all samples. Coloration was assessed 5 times as follows: initial color, immediately after staining, after whitening, after resin application, and after secondary staining. Color was measured using a spectrophotometer and recorded by using the CIE L*a*b* color space. The color changes after primary staining for the RI, RA, and control groups were 12.16 ± 3.50, 12.16 ± 3.38, and 15.81 ± 6.39, whereas those after secondary staining were 15.21 ± 7.19, 15.93 ± 4.31, and 26.62 ± 17.89. Color changes after secondary staining showed a significant difference between the RI and control groups. In the within-group comparison between primary and secondary staining, there was no significant difference found in the RI group only (p = 0.26). The results suggest that Color stability after tooth whitening can be improved using resin infiltration.
Ⅰ. 서 론
근래에 들어 임상 치의학의 심미적 수요가 증가하면서 중요한 화두가 되고 있다. 심미적인 만족도는 개인의 사회활동에도 영향을 끼칠 수 있을 정도로 현대 치의학에서는 간과할 수 없는 가치라 할 수 있다. 이러한 만족도는 주관적인 것이지만 치아에 대한 개인의 미적 평가는 그 색상에 크게 좌우되는 경향이 있다[1,2]. 치아의 색상을 변화시키는 착색의 요인으로는 흔히 기호식품이나 흡연 등 습관성 요소들을 들고 있으나, 미생물, 약물, 치과 재료, 개인의 유전적 요인들도 또한 치아 착색을 일으킬 수 있다[3,4]. 착색 치아의 색상을 회복하기 위한 방법으로서 치아 미백술은 가장 흔히 꼽는 선택이다. 치아 미백을 통한 치아 색상의 개선은 환자의 만족도와 밀접한 관련이 있다[5]. 최근의 사회적 요구에 부응하여 치아 미백술을 위한 시술과 관련 제품의 종류 또한 늘어나고 있는데 반하여, 지금까지 소개된 재료들은 치질 내 무기질과 유기질에 영향을 미쳐 치질을 탈회시키거나 치수 과민을 초래할 수 있으며, 시술 직후에 재 착색에 취약하다는 한계가 보고된 바 있다[6-9]. 이러한 약점은 회복한 색상의 단기간 내 악화를 유발하여 환자의 만족도가 감소되고 결과적인 재치료는 소모적인 부담을 초래하게 된다. 치아 착색 뿐 아니라 전치부에 발생하는 백색병소 또한 환자의 심미적 만족도를 저하시키는 요인 중 하나이다. 이러한 백색병소를 치료하기 위한 방법 중 치아의 재광화는 보존적 관점에서 우선 선택되는 치료 방법이지만, 색상 회복의 측면에서는 기여도가 미미한 수준이다[10,11]. 또한 전통적으로 많이 사용되어 온 micro-abrasion 술식은 법랑질의 과다한 소실을 동반하므로 적용에 주의가 필요하다[12]. 이러한 기존 방법들의 한계를 보완할 목적으로 최근에 개발된 resin infiltration(RI)가 백색병소의 새로운 치료방법으로 주목받고 있다. RI는 진행 중인 초기 법랑질 우식 병소에 저점성의 액상 레진을 침투시킴으로써, 산의 확산경로를 차단하여 우식의 진행을 막고, 치질의 기계적 성질을 강화하게 되는데, 이 때 부가적인 효과로 법랑질의 광굴절률이 건전치질과 유사하게 바뀌어 치질의 색상과 투명도를 회복시킬 수 있다[13-15]. 이러한 적용이 유효하기 위해서는 기존의 수복용 레진이나 레진 접착제들 보다 높은 침투력을 가져 충분한 침투깊이를 확보할 수 있는 높은 흐름성의 재료가 요구되는데, 최근 89.1% tetraethyleneglycol dimethacrylate, 9.9% ethanol, 0.5% camphorquinone, 0.5% ethyl 4-(dimethylamino)benzoate를 그 조성으로 하는 RI가 개발되어 시판되고 있다(Icon®, DMG, Hamburg, Germany). RI는 인접면 초기우식 병소에 대한 비침습적인 치료방법으로 개발되었으나, 전치부 백색병소의 심미적 개선에 대한 가능성이 보고되었고 그 가능성에 대한 이어진 선행 연구에서 효능이 입증된 바 있다[15,16]. 이 외에도 많은 연구에서 RI의 심미적 활용도에 대해 다양한 연구가 이루어지고 있으나, 그 색조 안정성에 대해서는 엇갈리는 의견이 제시되고 있다[17,18]. 이러한 심미적인 목적 외에도 내산성 증가를 위한 RI의 활용방안도 연구된 바 있는데[19], 이처럼 RI는 새로운 치료 방법으로서, 그 활용분야에 대해 더욱 많은 연구가 필요한 상황이라 할 수 있다.
미백 직후에 착색에 취약한 단점은 초기 우식이나 맹출 직후의 치아처럼 치아 법랑질의 증가된 다공성에 기인한다[20,21]. RI는 모세관 현상의 기전으로 치질내로 침투하며, 결과적으로 치질의 다공성을 감소시키게 된다. RI의 적용에 따른 다공성의 감소가 미백 후 치아의 색조 재침착에 대한 저항성을 증가시킬 수 있다면, 미백효과의 장기적 색조 안정성에도 크게 기여하여 반복된 재치료의 필요성을 크게 줄여줄 것으로 판단되었다. 이에 본 연구는 RI가 미백 시술을 받은 치아의 색조 안정성에 기여하는 수준을 조사함으로써, 미백술의 효율 증대와 RI의 새로운 활용방안에 대한 타당성을 평가하였다.
Ⅱ. 연구 재료 및 방법
1. 시편 채취 및 준비
건전한 총 40개 우치의 전치 순면에서 40개의 치아 절편을 채취하여 연구과정이 시작될 때까지 37℃, 0.1% thymol 용액에 보관하였다. 절편을 다이아몬드 bur로 절단해 4 × 4 mm 이상의 크기로 만들고, 협면이 바닥을 향하도록 원통형 PVC matrix에 넣어 에폭시 레진에 매몰하였다. 매몰된 시편을 연마기를 이용하여 순차적으로(1200, 2400, 4000 grit) 연마하여(Labopol-5, Struers, Ballerup, Denmark)색조 측정을 위한 평활한 법랑질 시편을 제작하였다.
2. 연구 과정
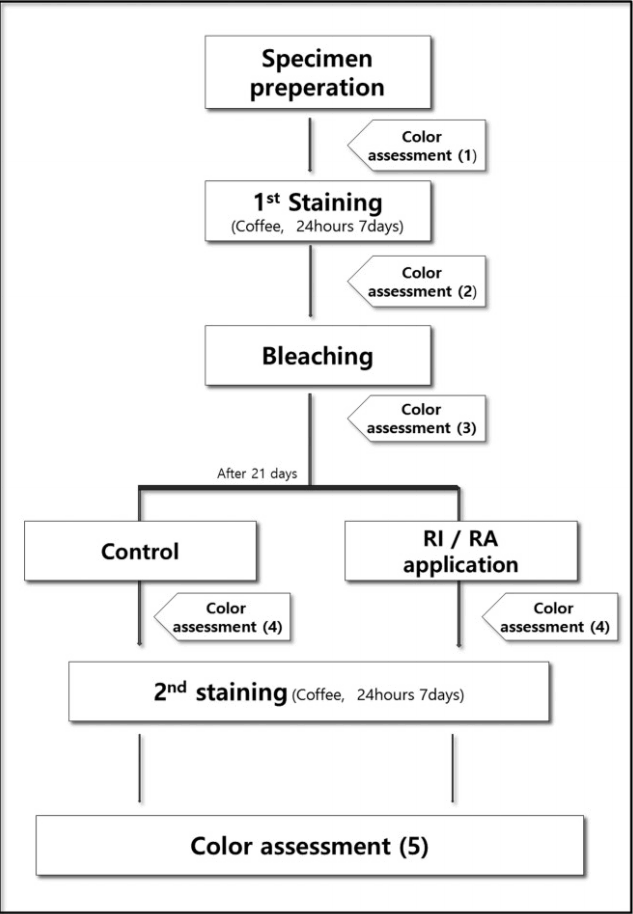
전체의 연구과정은 Fig. 1의 흐름도에 나타나 있으며 사용된 RI와 레진 접착제의 조성은 Table 1에 기술하였다. 연구 과정은 다음과 같다. 준비된 시편을 37℃에서 7일간 100 mL의 커피(칸타타 스위트블랙, 롯데칠성음료, 서울, 한국)에 담가 1차 착색하였다. 착색에 사용된 커피는 24시간 마다 새로 교체하였다. 착색 후 15% 과산화요소가 함유된 미백제(Opalescence 15%, Opalescence, Ultradent, South Jordan, USA)를 37℃에서 1일 6시간씩 7일간 적용하였는데, 이때 시편의 치질이 미백제로 완전히 덮이도록 하였다. 미백 완료 후 21일간 37℃에서 생리 식염수에 보관하였고 보관 용액은 매일 교체하였다. 21일간 보관한 후, 시편을 무작위로 3개 군으로 나누었다. RI군과 레진 접착제(RA)군에는 각 15개, 대조군에는 10개의 시편을 할당하였다. 각 군에는 다음의 방법으로 해당 재료를 적용하였다.RI군: 러버컵을 이용 표면세마를 시행하고 압축공기로 20초간 건조한 뒤 Icon-etch(15% hydrochloric acid gel)를 2분간 적용하였다. Etchant를 흡입하여 제거한 후, 30초간 수세하고 Icon-dry를 도포하고 30초 후 압축공기로 건조시켰다. Icon-infiltrant를 적용한 뒤 면구를 이용해서 과잉의 재료를 제거하고 3분후 40초간 광중합하였다. Icon-infiltrant를 재적용한 뒤 1분후 40초간 다시 광중합을 시행하였다. 마지막으로 러버컵을 이용해서 표면활택을 시행하였다.

Composition of the resin infiltration and the resin adhesive used in this study accordingly to the manufacturers' information
RA군: 러버컵을 이용해서 표면세마를 시행하고 압축공기로 20초간 건조시킨 뒤, CLEARFIL™ SE bond(Kuraray, Osaka, Japan)의 프라이머를 20초간 적용하였다. 압축공기를 이용하여 10초간 건조한 뒤 CLEARFIL™ SE bond의 bond를 도포하였다. 압축공기를 이용해 건조시키고 10초간 광중합을 시행한 후, 마지막으로 러버컵으로 표면활택을 시행하였다.
대조군: 러버컵을 이용해서 표면세마를 시행하였다. 그 후 모든 시편을 대상으로 1차 착색과 동일한 방법으로 2차 착색을 시행하였다.
3. 색조의 평가
CIE L*a*b* 색조계를 이용하여 색조를 기록하였다. CIE L*a*b* 색공간은 가시범위의 모든 색을 표현할 수 있는 색조계로 L*값은 명암을 나타내고, L* = 0 는 가장 어두운 검은 색을, L* = 100은 가장 밝은 흰색을 나타내며, a*는 양의 값은 붉은 색 음의 값은 녹색, b*는 양의 값은 황색, 음의 값은 청색을 띄는 것을 의미하며, 일반적으로 ± 100의 값으로 표현한다[22]. 색조의 변화량을 측정하기 위하여 다음과 같은 식을 이용하였다.
색조측정은 spectrophotometer(CM-3600d, Minolta Co., Ltd., Osaka, Japan)를 이용하였다. 전 연구과정에서 색조 평가는 최초상태, 1차 착색 직후, 미백제 적용 직후, 미백 후 후처치 및 2차 착색 후의 총 5회 색조측정을 실시하였다. 2차 착색 전후의 시편사진을 디지털카메라(D3300, Nikon, Japan), 접사렌즈(AF-S Micro NIKKOR 60mm 1:2.8G ED, Nikon, Tokyo, Japan) 및 플래시(Sigma EM-140 DG, Sigma Corp, Kanagawa, Japan)를 이용하여 촬영하였으며, 셔터속도 1/200, F29, ISO 400, Auto white balance의 세팅을 사용하였다. 외부의 빛을 차단하기 위하여 암실 안에서 촬영하였고 광도계를 사용하여 일정량의 빛이 조사될 수 있도록 하였다.
4. 통계 분석
통계 분석은 R(ver 3.2.2)(www.r-project.org)을 사용하였다. 신뢰구간은 95%, 유의수준은 p < 0.05 로 고려하였다. 각 군에서의 단계별 비교, 각 군에서의 ΔE값 변화량의 비교, 군간 ΔE값의 비교는 비모수적 방법인 Kruskal-Wallis test와 Mann-Whitney test를 통해서 검정하였고, 사후검정은 Dunn test를 통해서 실시하였다(Bonferroni Adjustment).
Ⅲ. 연구 성적
1. 임의선택에 대한 오류 검증
임의선택에 대한 오류의 여부를 검증하기 위하여 일차 착색 후의 색조변화량을 군간 비교하였다. 세 군간의 유의한 차이는 없었다(Kruskal-Wallis test, p= 0.15). Dunn test를 통한 사후검정 결과 RI군과 RA군(p= 1.00), RI군과 대조군(p= 0.16), RA군과 대조군(p= 0.10)사이에서도 유의미한 차이가 없었다. 일차 착색 후의 군간 색조변화량의 비교에 있어 차이가 존재하지 않았기에 시편의 임의 분배에는 문제가 없었던 것으로 판단한다.
2. 단계별 L* 값의 비교
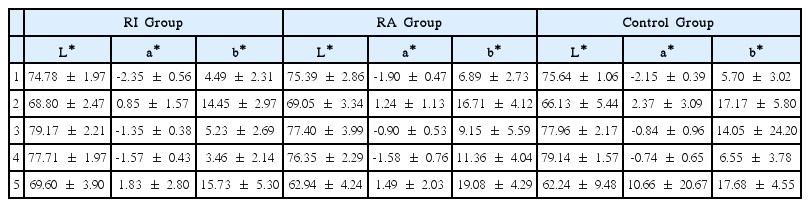
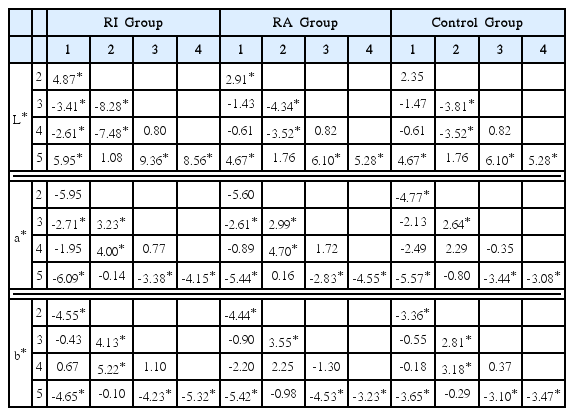
단계별 L* 값은 Table 2에, 군별 L* 값의 단계간 비교는 Table 3에 제시하였다. RI군, RA군, 대조군 모두에서 재료 적용으로 인한 L* 값의 변화(3, 4단계 사이의 값의 변화)는 유의하지 않았다. 그 외 단계에서는 모든 군이 착색 후 L* 값이 감소하였으며, 미백 후에는 증가, 미백 후 후 처치 한 뒤 2차 착색하였을 경우 감소하는 것으로 관찰되었다. RI군의 경우 미백 후 처음의 L* 값보다 더 증가하여 더욱 밝게 미백되었으나(p < 0.05), RA군과 대조군의 경우에는 처음 상태와 유사하게 미백되었음을 확인할 수 있었다.
3. 단계별 a* 값의 비교
단계별 a* 값은 Table 2에, 군별 a* 값의 단계간 비교는 Table 3에 제시하였다. 착색 후 모든 시편은 a* 값이 증가하였으며(p < 0.05), 커피의 착색으로 보다 붉은 색조를 띄게 되었음을 알 수 있었다. 재료를 적용하더라도 RI군과 RA군 모두에서 유의한 변화를 보이지 않았다. 미백을 통하여 처음 색조와 보다 가깝게 회복되었으나 그 회복량은 군별로 차이가 존재하였다.
4. 단계별 b* 값의 비교
단계별 b* 값은 Table 2에, 군별 b* 값의 단계간 비교는 Table 3에 제시하였다. 착색 후 모든 시편에서 b* 값이 증가하였으며(p < 0.05), 이것은 시편이 보다 황색을 띄게 되었음을 의미한다. 재료를 적용하더라도 그 변화량은 RI군과 RA군 모두에서 유의성이 없었다. 미백은 황색에서 청색으로의 변화를 뜻하는 b* 값의 감소를 나타냈으며, 모든 군에서 미백을 통해 착색 전 처음의 b* 값과 유사하게 회복되었다.
5. 군별 후 처치 시행 후 2차 착색에 의한 군간 색조 변화량 비교
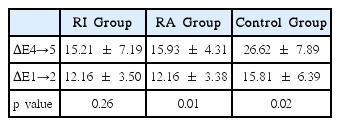
각 군에 미백 후 후 처치를 시행한 뒤 2차 착색을 실시하고 2차 착색 전후의 색조변화량을 계산하였다(ΔE4→5). 군간 차이를 비모수적 방법인 Kruskal-Wallis test를 통해서 검정하였고, 사후 검정은 Dunn test(Bonferroni Adjustment)를 통해서 시행하였다. 색조변화량(ΔE4→5)의 측정 결과, RI군은 15.21 ± 7.19, RA군은 15.93 ± 4.31, 대조군은 26.62 ± 17.89의 결과를 나타내었다. 군간 비교는 Fig. 2에 모식도로 나타내었다. Kruskal-Wallis rank sum test에서 군간 차이는 통계적 유의성이 존재하지 않았으나(p= 0.06), 사후 검정을 통하여 RI군과 대조군간의 차이는 유의한 것으로 나타났다(p < 0.05).
6. 1차 착색에 대한 색조 변화량과 2차 착색에 대한 색조 변화량의 차이
1차 착색 후 각 군의 색조변화량(ΔE1→2) 과 미백 후 군별 후 처치를 시행하고 2차 착색 후의 색조변화량(ΔE4→5)간의 차이를 Mann-Whitney test를 통하여 비교함으로써, 미백 직후의 착색에 대한 각 군의 저항성을 알아보고자 하였다(Table 4). ΔE1→2는 RI군의 경우 12.16 ± 3.50, RA군은 12.16 ± 3.38 그리고 대조군은 15.81 ± 6.39로 나타났으며, ΔE4→5의 경우 RI군은 15.21 ± 7.19, RA군은 15.93 ± 4.31, 대조군은 26.62 ± 17.89의 결과를 보였다. 1차 착색에 의한 색조 변화량과 후처치가 이뤄진 뒤 2차 착색에 의한 색조 변화량에 있어서, RI군의 경우 1차와 2차 착색시의 색조변화량에서 유의한 차이가 존재하지 않았던 반면(p= 0.26), RA군과 대조군에서는 2차 착색 시 더 많은 색조 변화를 보이는 것으로 나타났다(p < 0.05)(Fig. 3).

Comparison of color changes between variations after first staining and after second staining for each group.
미백시술 후 3주의 시간을 두었음에도 불구하고 RA군과 대조군의 경우에는 치아 미백 후 착색에 취약해 지는 한계를 극복하지 못하여, 2차 착색 시 더 많은 색조 변화량을 나타내었다. 반면, RI군은 RI에 의해 착색에 대한 저항성이 증가되었음을 알 수 있었다.
Ⅳ. 총괄 및 고찰
역사적으로 치아 미백술은 지속적인 발전을 거듭해왔다. 1800년대 후반에서 1900년대 초반까지 매년 발표된 관련 논문이 수십편에 달할 정도였으니 임상가들의 지대한 관심을 미루어 짐작할 수 있다[23]. 이처럼 치아의 색상은 치과에서 중요한 화두 중 하나이며, 환자들이 자신의 치아를 평가할 때 가장 큰 비중을 차지하는 평가기준이다[2]. 치아 미백의 완료를 정하는 시점에서 치과의사와 환자간의 의견차이가 존재하는 상황은 치아 미백을 시행했던 치과의사라면 누구나 한번쯤은 겪어보았을 것인데, 이것은 치과의사와 환자의 평가기준과 기대체가 다르기 때문이며, 특히 흰 색상에 대한 선호도가 일반인들에게서 더욱 높기 때문일 것이다[24,25]. 색상에 따른 심미성이라는 것은 절대적인 값이 존재하는 것이 아니기 때문에 사람마다 그 평가가 다를 수 있으며 개인마다 만족할 수 있는 치아 색상의 범위 또한 다를 것이다.
현재 미백에 사용되는 재료는 크게 과산화수소와 과산화요소의 두 계열로 양분할 수 있다[6,24]. 치아 착색은 유기질이 치면의 치질과 결합하여 유기질 간에 단일 혹은 이중결합을 형성함으로써 일어나게 되는데, 미백효과는 이러한 유기질, 즉 발색단의 결합들을 파괴하는 작용을 하는 것으로 추정한다[27]. 그러나 아직 과산화수소와 과산화요소의 정확한 기전에 대해서는 밝혀지지 않았으며, 이 재료들이 산화물을 형성하는 반응 또한 온도, pH, 빛, 전이원소의 존재 유무에 따라 다양하게 나타날 수 있다[27,28]. 이러한 재료들에는 여러 가지 부작용이 존재하는데, 지각과민은 전문가용(In-office)과 자가미백(Night-guard bleaching) 모두에서 가장 흔한 부작용의 하나로 보고되고 있다[29-31]. Peroxide가 법랑질과 상아질을 통과하여 치수강까지 도달할 수 있다는 점이 이러한 지각과민의 원인으로 추정되나 아직 명확한 기전은 밝혀진 바 없다[32]. 단, 이전 지각과민의 기왕력을 가진 환자의 경우 미백으로 인한 지각과민을 겪게 될 가능성이 높으므로 주의가 요구된다[9].
환자들이 치아 미백 후에 겪는 또 다른 불편 중의 하나는 재착색으로 인한 부가적 미백치료의 필요를 들 수 있다. 미백은 법랑질 구조에 손상을 일으켜 치아를 착색에 더욱 취약하게 만든다[6-9]. 본 연구의 대조군에서도 미백제 적용 전보다 미백제 적용 후의 착색에서 더 많은 색조 변화를 보인 것으로도 이런 사실을 확인할 수 있었다. Friedman 등[33]의 연구에서는 1-2년 후 10%, 2-8년 후에는 40%의 환자들에서 재치료가 필요하였고, Holmstrup 등[34]의 연구에서는 3년 뒤 20.3%의 환자들에게 재치료가 필요했던 것으로 나타났다. 이처럼 치아 미백은 영구적일 수 없으며 2차 착색은 필연적으로 일어날 수 밖에 없다. 결국 환자들의 재치료에 대한 불만을 줄이기 위하여, 미백 후 2차 착색을 방지함으로써 치아의 색조 안정성을 높이기 위한 방법의 개발이 필요하다고 생각한다.
치아 미백시 술자가 주의할 점 중 하나로 치아 미백 후 치질에 남아있는 잔류 산화물이 레진의 중합을 방해한다는 것을 들 수 있다[35,36]. 따라서 레진 수복 시 이에 대한 대처가 필요한데, Cavalli 등[36]은 과산화요소의 농도는 접착력의 저하의 정도나 기간과는 관련이 없고, 3주 정도의 시간이 경과한 후에 레진 접착이 이루어져야 접착력 저하를 피할 수 있다고 보고하였다. 반면, Dishman 등[35]은 in vitro 연구에서 24시간 경과 후에는 미백제를 적용한 시편과 그렇지 않았던 시편 간 접착력의 차이가 존재하지 않는 것으로 보고한 바 있다. 따라서 환자가 미백과 레진 수복 치료가 모두 필요한 상황이라면 미백을 실시한 후 일정 기간이 경과 한 후 수복을 실시하거나, 미백 치료 전 수복을 실시하여야 할 것이다. 본 연구에서도 이러한 중합 저하 효과를 방지하기 위하여 미백제 적용 후 3주 뒤 RI 및 레진 접착제 도포를 시행하였다. 이 외에 미백 후 즉시 레진수복을 가능케 하기 위하여 10% sodium ascorbate를 이용해 후처리하는 방법이 보고된 바 있다[37,38].
이번 연구에서 사용된 자가 부식 레진 접착제는 별도의 산부식 과정과 그에 수반되는 수세-건조과정이 필요하지 않기 때문에 술자의 숙련도에 따른 술식 결과에 대한 영향이 적다는 장점을 가지고 있다[39,40]. 따라서 개개의 시편에 대한 적용에 있어 그 오류를 줄임으로써 시편간 균일성을 도모할 수 있다. 뿐만 아니라 일반적인 치수민감성의 치료에 이용되는 방법 중 하나로, 미백 후 부작용으로 나타나는 지각과민의 처치에 사용될 가능성 또한 높다 하겠다[41,42]. 이에 이번 연구에서 RI와 비교할 재료로서 자가 부식 레진 접착제의 한 종류인 CLEARFIL™ SE bond를 선정하였다.
인접면 우식의 치료를 목적으로 탄생한 RI는 법랑질 표층소실을 감소시키며, 우식 법랑질의 물성을 증가시킬 수 있음이 보고되었다[43,44]. 또한 병소의 광굴절률을 정상치질과 유사하게 회복시켜 치아의 본래 색상을 되찾게 하는 성질이 발견되어 전치부 백색 병소를 차폐하는 용도로 활용 및 이에 대한 평가가 진행되고 있는데[16,45], 우치에 형성한 인공우식에서 RI는 효과적으로 백색병소와 정상치질의 색조 차이를 감소시킬 수 있었다[16,18,45,46]. 나아가 교정 치료 등의 이유로 백색병소가 생긴 환자들에 대해 RI를 적용함으로써 심미적인 개선과 더불어 환자의 만족도 또한 증가시킬 수 있었다는 많은 보고들이 있다[16,45,46]. 그 외 불소증으로 인한 치아의 백화현상을 치료한 케이스도 보고된 바 있다[49]. 이처럼 RI는 백색병소에 대한 치료 및 심미성 증진의 효과를 동시에 얻을 수 있는 치료로 주목받고 있다[16,50,51].
이러한 성과들을 바탕으로 RI의 색조안정성에 대한 연구도 활발히 진행되고 있는데, 교정치료로 인한 다수의 백색병소 환자를 대상으로 한 6개월, 12개월 후 예후 관찰에서 RI는 충분한 색조안정성을 나타내었다[17,52]. 단 우치를 대상으로 한 in vitro 연구에서는 색조안정성이 낮다는 보고와 그렇지 않다는 보고가 혼재한다[18,53,54]. 그러나 최근 Arau′jo 등[55]의 연구에서 RI를 적용한 뒤 색조 변화가 있더라도 미백제를 적용함으로써 이전 색조를 회복할 수 있는 것으로 보고되었는데, 따라서 색조 침착이 침투한 레진상에 대해 비가역적으로 일어날 것이라는 두려움을 가질 필요는 없을 것으로 판단되었다. 단 본 연구에서는 초기우식 병소가 아닌 정상치질에 RI의 적용이 이루어졌기에 권고되는 적응증과는 차이가 존재한다. 그러나 이전 연구에서 정상치질(D0) 및 D1 우식에 적용된 RI도 레진 접착제와 비슷한 침투깊이를 얻을 수 있었고, 정상치질에 적용 시에도 내산성의 증가가 있었다는 연구 결과도 있기에[19,56], 그 적용목적과 그로 인한 이득이 확고하다면 정상치질에의 적용도 금기증이라 할 수는 없을 것으로 생각되었다. 또한 미백제가 적용된 치아는 내산성이 저하되어 RI를 위한 전처리에 정상 치질에 비하여 반응성이 증가되어 더 많은 치질의 파괴가 일어날 것이라는 우려가 있을 수 있으나, 선행 연구에서 과산화수소또는 과산화요소의 적용은 치아의 내산성의 저하에 대해 중대한 임상적 연관성이 없음이 입증된바 있다[57].
본 연구에서는 미백 효과의 색조 안정성을 향상시킬 방법의 하나로서, RI의 활용 타당성을 평가해 본 결과, 이를 적용함으로써 치아의 색조 안정성의 향상을 도모할 수 있을 것으로 사료되며 미백 후 법랑질 구조의 손상으로 2차 착색에 취약해지는 미백제의 한계를 보완할 수 있을 것으로 사료되었다. 다만 그 색조 안정성에 있어서의 in vitro 연구에서 상반된 보고가 존재하는 것은 병소의 불연속성 및 침투깊이의 불균일함에 기인한 것이라 생각되는데, 본 연구에서도 RI군은 시편의 색조변화의 편차가 RA군에 비하여 큰 것을 관찰할 수 있었다. 그러나 RI를 적용하여도 재 미백 등을 통하여 재 착색된 치아의 색조를 다시 개선할 수 있는 점으로 판단하건데, 심미적 용도로의 RI 활용성을 낮추지는 않을 것으로 생각되었다. 그러나 본 연구로 나타난 결과물이 좀 더 공고한 근거로 제시되기 위해서는 여러 가지 보완하여야 할 점들이 있을 것으로 생각되었다. 우선 염산을 이용한 RI 또한 치질 파괴를 동반하는 만큼, 미백후의 약화된 치질에 이를 적용하여 추가적인 치질 손상을 감수하면서까지 이를 적용할 가치가 있는지에 대한 보다 확고한 근거를 제시할 연구가 필요할 것이다. 또한 우치가 아닌 인간의 치아를 대상으로 한 연구와 아울러, 임상 연구가 이어진다면 학술적, 임상적 측면에서 가치가 훨씬 증가될 것으로 판단하며, 이에 대한 추후 연구가 필요하다.
Ⅴ. 결 론
미백 후 치아는 다공성이 증가하게 되며 이로 인해 낮은 색조 안정성을 나타내게 된다. 본 연구에서는 이러한 다공성을 감소시켜 미백 후 치아의 색조안정성을 향상시킬 목적으로 RI를 시행하고 그 활용의 타당성을 검토하여 다음과 같은 결론을 얻었다. 착색 치아의 미백술 직후에 재착색에 더욱 취약함을 확인할 수 있었다. 미백 치아에 대한 레진 접착제의 적용으로는 미백 직후의 이러한 낮은 색조안정성을 보완할 수 없었고, RI를 적용할 경우 미백 및 재 착색 후에 적은 량의 색조 변화를 보여 저항성이 증가하였음을 알 수 있었다.
본 연구를 통하여 미백 치아를 대상으로 RI를 시행함으로써 미백 직후 치아의 낮은 색조안정성을 보완할 수 있을 것으로 판단한다.