불소를 함유한 교정용 접착제의 브라켓 주변 법랑질 탈회 예방 효과
Effect of a Fluoride - Containing Orthodontic Primer for Preventing Enamel Demineralization around Bracket
Article information
Abstract
브라켓 주위에 발생되는 법랑질 탈회는 교정 치료 시 극복해야 할 문제 중 하나이다. 본 연구는 교정용 브라켓 부착 시 사용되는 접착제 중 불소를 함유하는 교정용 프라이머의 적용이 법랑질 탈회 예방 및 재광화 유도에 미치는 효과를 알아보고자 시행되었다. 건전한 표면을 가진 발치 된 소의 절치 50개를 실험재료로 하여 법랑질 처리 방법에 따라 3개 군으로 분류하였다: (I) 아무처리하지 않은 시편, (II) 불소를 함유한 교정용 프라이머인 Light Bond™로 처리한 시편, (III) 전통적으로 불소를 함유하지 않는 프라이머인 Transbond™ XT Primer로 처리한 시편. 각 군을 인공우식용액에서 탈회시킨 다음 Q-ray view로 관찰하고, 비커스 표면미세경도 측정 및 편광현미경을 이용하여 우식 양상을 평가하였다. 인공 탈회 후 프라이머는 치아 표면에서 떨어져 나가 35 - 50% 잔존하는 것으로 보인다. 표면미세경도는 Light Bond™를 직접 적용한 법랑질 표면에서 가장 높았으나 유의한 차이는 없었다. 하지만 Light Bond™를 적용한 인접부위의 법랑질 표면미세경도는 아무처리를 하지 않은 대조군보다 유의하게 높은 값을 보였다. 편광현미경을 통해 관찰한 소견으로 Light Bond™를 직접 적용한 법랑질 표면은 탈회가 거의 나타나지 않았으며, Light Bond™의 인접부위에서는 가장 얕은 우식 양상과 재광화 소견을 보였다. 이상의 연구결과, 교정치료 시 법랑질 탈회의 발생을 줄이기 위해서 브라켓 부착 시 불소를 함유하는 프라이머의 사용이 유용함을 시사하는 바이다.
Trans Abstract
During orthodontic treatment, formation of white spot lesions (WSLs) around brackets has long been recognized as a potential risk. This study performed to investigate effect of preventing enamel demineralization and remineralization by application of fluoride-containing orthodontic primer. Fifty extracted bovine incisors teeth were randomly allocated to 3 groups: (I) Non-preparation specimens, (II) Application of Light Bond™ as fluoride containing orthodontic primer, (III) Application of Transbond™ XT Primer as traditional orthodontic primer without fluoride. Each group is demineralized under artificial carious solution. The demineralization pattern was evaluated using a Q-ray view, Vickers hardness test and polarized light microscope. The remained primer was calculated as 35 - 50%. The highest surface microhardness was shown on Light Bond™ surface. There were statistically significant differences in Vickers microhardness number between adjacent areas of Light Bond™ and non-prepared area. There was almost no demineralization of the enamel surface under the Light Bond™. At the adjacent site of Light Bond™, the shallow caries pattern and remineralization appearance were also observed. These results suggest that the use of fluoride-containing primers may be useful for bracket attachment to reduce enamel demineralization during orthodontic treatment.
Ⅰ. 서 론
고정식 교정 장치 장착 시 구강위생 상태가 저하되어 밴드나 브라켓 주변에 치태가 침착 되고, 치태 내 세균에 의해 산이 형성되어 브라켓 주변의 법랑질 표면에 탈회가 나타난다[1,2]. 고정식 교정 장치 사용 일주일 만에 치은 쪽으로부터 백색 반점이 뚜렷하게 생겨 있음을 종종 관찰 할 수 있다[3,4]. 브라켓 주위에 발생되는 백색 병소는 교정 치료 시 극복해야 할 문제 중 하나이다[5].
교정치료 시 발생되는 법랑질 탈회를 예방하기 위한 여러 시도가 있어 왔다. 우식 예방 측면의 다수 연구에서 불소가 법랑질의 탈회를 예방한다는 과학적 근거를 제시하고 있다[6,7]. 교정치료 시 환자의 협조를 덜 필요로 하면서 법랑질의 탈회를 최소화하기 위한 접근으로 교정용 접착 레진(orthodontic bonding resin)이나 레진 전 처리제인 프라이머(primer)에 불소를 첨가하려는 시도가 있었다[8-10]. Frazier 등[11]은 불소를 함유한 프라이머를 브라켓 주위로 도포하는 것이 법랑질 탈회 방지에 효과적임을 보고한 바 있다. 하지만 초기의 불소 함유 교정용 프라이머는 물리적 성질과 불소 방출량에 있어 임상에서의 적용이 어려웠다. 최근에 상용화 된 Light Bond™ (Reliance Orthodontic Products, Inc., Itasca, IL, USA)는 불소를 함유하는 교정용 프라이머로써 브라켓 접착을 위한 충분한 강도를 가지며 오랜 시간 불소를 방출한다고 소개되고 있다. 그러나 소수의 문헌만이 불소 함유 불소 함유 프라이머의 유용함에 대해 언급하고 있다.
본 연구는 불소를 함유하는 교정용 프라이머의 적용이 법랑질 탈회 방지 측면에 미치는 효과를 평가하고 교정치료 시 법랑질 탈회 예방에 도움이 되고자 시행하였다.
Ⅱ. 연구 재료 및 방법
1. 연구 재료
육안으로 보아 우식이 없고 표면 파절과 균열이 없는 건전한 법랑질을 가진 우치 90개를 발치 직후 0.1% Thymol 용액에 보관하였다.
교정용 접착제는 불소를 함유하는 교정용 프라이머인 Light Bond™ (Reliance Orthodontic Products, Inc., Itasca, IL, USA)와 불소를 함유하지 않는 전통적인 Transbond™ XT Primer (3M Unitek, Monrovia, Calif)를 사용하였다.
2. 연구 방법
1) 인공우식유발
(1) 시편 제작
시편 제작을 위해 17 × 22 × 12 mm인 아크릴 주형에 우치의 순면을 위로 향하게 두고 아크릴릭 레진(acrylic resin)에 매몰하였다. 치아의 순면에 8 × 8 mm의 창을 제외한 나머지 치면은 nail varnish를 도포하여 인공우식용액에 대한 보호막을 형성하였다. 그 후 시편을 연마기(Mataserv grinder-polisher, Buehler, Germany)로 150 grit에서 600 grit까지 silicon carbide paper를 순차적으로 적용하여 표면을 연마 하였다.
준비된 시편 90개를 비커스 경도 측정기(KM-122, Akashi, Japan)를 사용하여 200 g 하중을 10초간 부여하여 실험 전 초기 표면미세경도(VHN: Vickers Hardness Number)를 측정하였다. 시편의 연마된 부위에서 무작위로 3회 이상 측정하여 각 값의 차이가 20 VHN 이내가 되도록 하였다. 표면미세경도가 260 - 300 VHN 범위 내에 있는 시편 50개를 선정하여 각 시편은 무작위로 3개의 군으로 분류하였다(Table 1).
치면 처리는 술자 간 오차를 줄이기 위해 한 명의 실험자에 의해 시행되었다. I군은 대조군으로써 준비된 시편에 아무런 치면 처리를 하지 않았다. II군과 III군은 시편 중앙을 반으로 나누어 왼쪽과 오른쪽을 다르게 처리하였다. 이를 통해 프라이머를 직접 적용한 법랑질과 프라이머를 적용한 인접부위 법랑질에 미치는 효과를 비교하고자 하였다. II군 시편의 왼쪽 부위만 37% 인산으로 30초간 적용한 후 충분히 수세 및 건조 하였다. 산 부식된 법랑질 표면에 브러시를 사용하여 Light Bond™ 한 방울을 얇고 균등하게 바르고 압축 공기로 접착제가 넓게 도포되도록 한 뒤 광중합기(Valo Curing Light, Ultradent Products Inc., USA)를 사용하여 3초간 광중합 시켰다. 오른쪽 부위는 아무런 처리도 하지 않았다. III군도 같은 방법으로 왼쪽 부위는 산 부식 후 Transbond™ XT Primer를 적용하고, 오른쪽 부위는 아무런 처리도 하지 않았다.
(2) 인공우식용액 제조 및 인공 우식의 유발
인공우식용액은 1987년 White 등[12]이 실험에 사용한 방법에 따라 제조하였다. 50 mL 1 M 젖산(Sigma, USA)에 2차 증류수를 첨가하여 500 mL로 만들고, 여기에 50% 수산화나트륨 용액(Sigma, USA)을 첨가하여 pH를 5.0으로 조절하였다. 위 용액에 1.5 g HAP (tribase calcium phosphate tribasic, Sigma, USA)을 첨가하는데, 20% 염산 용액으로 pH가 5.0을 유지한 상태로 30분간 교반기에서 용해시켰다. 용해가 끝난 용액은 여과지에 여과한 후 1% Carbopol 907® stock solution 200 mL와 50 mL 1.0 M 젖산을 첨가하고, 증류수를 넣어 1000 mL보다 조금 적은 양이 되도록 만들었다. 여기에 50% 수산화나트륨 용액을 첨가하여 pH 5.0을 맞추었다. 마지막으로 1000 mL가 되도록 증류수를 첨가하여 완성시켰다.
제조된 인공우식용액을 군별로 용기에 나누어 담은 후 준비된 시편을 넣고 밀봉하였다. 인공 우식 용액에 담근 시편을 37℃ 항온항습기에 14일 동안 보관하여 인공 우식을 유발시켰다. 시편을 넣은 용기는 하루에 1회씩 흔들어 주었다. 우식이 유발 된 50개의 시편을 생리 식염수로 충분히 세척하고 추가 탈회를 막기위해 탈이온수에 보관하였다.
2) 우식양상관찰
(1) Q-ray view를 이용한 육안검사
인공 우식이 유발된 시편의 법랑질 표면을 Q-ray view (All in One Bio Inc., Seoul, Korea)를 사용하여 잔존 프라이머와 백색병소의 발생을 평가하였다. 잔존 프라이머의 양은 0.1 × 0.1 mm2 격자 스프레드시트를 사용하여 면적을 계산 하였다.
(2) 표면미세경도 시험
시편의 탈회된 법랑질 표면을 미세경도측정기(HM-122, Akashi, Japan)를 사용하여 200 g 하중을 10초간 부여하여 비커스 표면미세경도(VHN: Vickers Hardness Number)를 측정하였다. 측정값은 탈회 된 부위에서 임의로 5곳을 선정하여 측정한 최대값과 최소값을 제외한 나머지 3개 값의 평균을 대표값으로 하였다.
(3) 편광현미경 관찰
각각의 시편은 시편 절단이 용이하게 교정용 아크릴릭 레진에 매립하고 주수 하에서 고속 절단기(RB 205 METSAW-HS, R&B Inc., Korea)를 사용하여 치아 장축에 수직인 근원심 방향으로 3군데(절단, 중앙, 치은 쪽)에서 800 ㎛ 두께로 절단하였다. 절단된 시편은 주수 하에 실리콘 카바이드 페이퍼로 활택하여 최종적으로 600 ㎛의 시편을 제작하였다. 준비된 시편은 편광현미경(CX31, Olympus, Japan)으로 40배율 및 100배율에서 관찰하고 최적의 영상을 컴퓨터 파일 형식으로 저장하였다. 촬영 된 이미지는 영상 분석 프로그램(Able Image Analyser, USA)을 통해 우식 병소의 양상이 분석되었다.
3) 통계 분석
접착제에 따른 표면미세경도 값의 유의차를 검증하기 위하여, 유의수준 95%에서 일원분산분석(One-way ANOVA)를 시행하고 Scheffe 법으로 사후 검정을 시행하였다. 통계처리는 IBM SPSS Statistics 프로그램(Version 23.0, IBM Corp., USA)을 이용하였다.
Ⅲ. 연구 성적
1. Q-ray view를 이용한 육안검사
인공 우식이 유발 된 50개 우치에서 백색병소의 형성을 평가하였다. 아무 처리도 하지 않은 I군의 우치 순면에 전반적으로 뚜렷하고 불투명한 백색 병소가 형성되었다. II군과 III군은 프라이머가 일부 떨어져 나가 잔존 프라이머량은 각각 50 - 70%, 30 - 40% 정도로 다양하게 나타났다. Light bond™를 적용한 II군에서 더 많은 프라이머가 남아있었다. 프라이머가 탈락한 부위에서는 탈회 양상이 관찰되지 않았으나, 프라이머를 적용하지 않은 오른쪽 부위는 불균일하고 얼룩진 탈회를 보였다.
2. 표면미세경도 측정
Table 2는 각 군의 인공 우식 유발 후 표면미세경도를 측정한 결과이다. 아무 처리 하지 않은 I군에서 59.28 ± 7.82 VHN로 가장 낮은 표면미세경도를 보였다. Light bond™를 사용한 II군의 표면미세경도는 232.79 ± 50.4 VHN으로 다른 실험군에 비해 가장 높은 값을 보였다. Trans bond™를 사용한 III군은 그보다 낮은 209.68 ± 30.74 VHN 이였다. 프라이머를 적용하지 않은 인접부위인 오른쪽 부위의 표면미세경도는 II군과 III군에서 각각 94.96 ± 11.87 VHN, 73.8 ± 12.18 VHN 으로 나타났다. 일원 분산 분석(One-way ANOVA) 결과 집단 간 차이가 있었으며, 사후 검정 결과 II군과 III군의 두 접착제 간 유의한 차이는 없었음을 알 수 있었다. 반면 II군의 Light bond™를 적용한 인접 부위의 표면미세경도는 대조군에 비하여 유의하게 높았다(P < 0.05).
3. 편광현미경 관찰
Fig. 1은 각 군에서 인공 우식 병소의 양상을 보여주는 편광현미경 사진이다. I군은 거칠고 다공성 표면과 넓고 두터운 병소 본체의 명확한 하방 경계로 초기 우식증의 특징적인 소견을 보인다. II군은 법랑질 표면에 light bond™가 필름과 같이 띠 형태로 관찰되고, 하방의 법랑질은 탈회가 일어나지 않고 보존되어있다. 인접 부위의 경우 우식 병소의 하방 경계가 희미해지고 전체적으로 병소의 깊이와 밀도가 감소되는 모습을 보여주고 있다. 또한 균일한 재광화 층이 법랑질 표층에 국한되어 관찰된다. 반면 III군은 전반적으로 I군보다 병소의 깊이가 다소 감소되었으나 유사한 모습을 보이고 재광화 양상은 관찰되지 않았다.
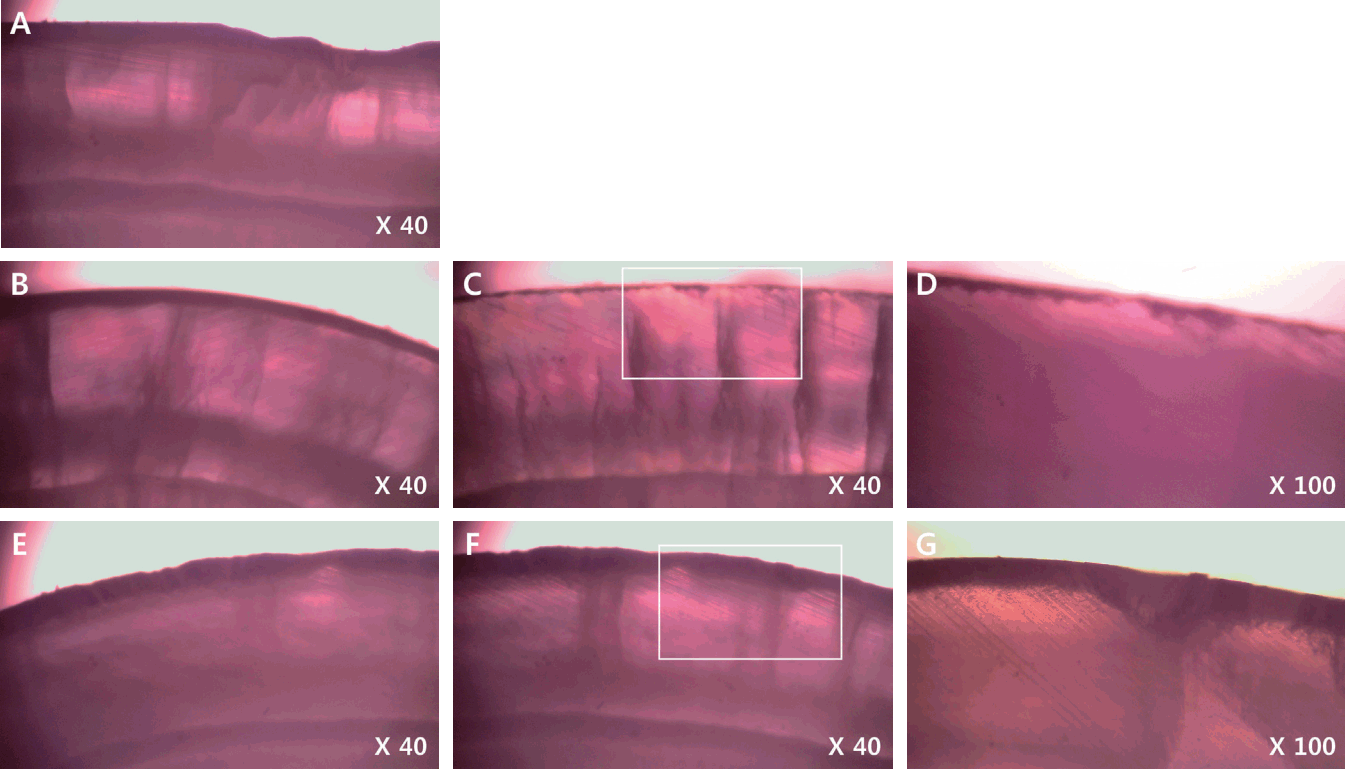
Polarized light microscopic images. A. Group I. Wide and deep caries lesion is observed. B. Group II. Light Bond™ film is show on the enamel surface. Under layer is intact. C, D. Group II. non-primer area. Demineralization of superficial layer of enamel is observed. E. Group III. Transbond™ XT Primer is exfoliated. F, G. Group III. non-primer area. Wide and deep caries lesion is observed.
Ⅳ. 총괄 및 고찰
1970년대 처음으로 교정 치료 시 우식으로부터 법랑질 표면을 보호하기 위해 프라이머를 치면 전체 넓게 도포하는 것이 시도되었다[13,14]. 이러한 초기 접근은 치면열구전색제로 부터 시작되었다. 그러나 이것들은 균일하게 원하는 만큼 도포하기 어려운 단점이 있었다[15]. 그리고 레진 표면이 중합될 때 발생되는 산소차단막이 또 다른 문제로 제기되었다[16]. 또 다른 연구 논문은 생체 내∙외 실험에서 다양한 교정용 프라이머 제품의 브라켓 접착 실패를 보고하였다[17]. 본 실험에 사용한 Light Bond™는 접착이나 중합에서 우수하다고 소개되었다. 또한 이 제품은 highly filled fluoride-releasing orthodontic primer로써 법랑질 보호막의 역할 뿐만 아니라 불소의 항우식 효과를 기대할 수 있다. 본 연구는 불소를 함유하는 교정용 프라이머인 Light Bond™가 법랑질 탈회 감소 혹은 예방 효과가 있음을 확인하였다.
본 연구에서 사용한 최신 조기우식진단 장비인 Q-ray view는 우식 부위를 시각적으로 구별시켜 치아에 복잡한 교정 장치가 부착된 환자에 있어서도 정확한 우식 진단을 용이하게 한다. 아무 처리 없이 인공우식을 유발시킨 대조군의 경우 치면 전반에 백색병소가 형성되었다. II군과 III군에서 프라이머는 부분적으로 탈락 되었고, Light bond™가 Transbond™ 보다 우식 환경에서 좀 더 오랜 시간 잔존하는 것으로 보인다. 평균 교정 치료기간이 대략 24 - 30개월인 것을 감안하면 프라이머가 치료 기간 동안 치아 표면에 장기간 유지되는 것이 법랑질 탈회예방을 위해 중요하다. 이전의 실험적 연구에 의하면 법랑질 표면의 교정용 프라이머가 칫솔질이나 저작과 같은 기계적 마모에 의해 탈락되는 것을 보고하였다[18]. 초기의 unfilled 혹은 lightly filled bonding primer가 생체 외 실험에서는 탈회 감소에 효과가 있을 것으로 보였으나 임상적으로는 그 결과를 뒷받침해주지 못한 이유이다[19,20]. 반면 high filled bonding primer는 칫솔질에도 충분한 마모저항성을 보이며 법랑질 탈회 감소에 효과적인 것으로 보인다[18]. Light bond™는 highly filled primer로써 우수한 마모저항성을 보이며 Transbond™ 보다 우식 조건에서 더 저항성이 있음을 확인하였다.
불소를 함유한 프라이머의 항우식 효과를 평가하기 위해 비커스 표면미세경도를 측정하였다. Light bond™와 Transbond™를 직접 적용한 법랑질의 표면미세경도는 통계적으로 유의한 차이를 보이지 않았다. 반면 두 프라이머를 적용한 인접 부위의 법랑질에서는 표면미세경도에 유의한 차이가 있었는데, Light bond™를 적용한 인접부위의 법랑질 표면미세경도가 더 높았다. 이러한 결과는 프라이머에서 유리된 불소가 탈회된 인접법랑질의 재광화를 촉진하여 항우식 효과가 나타난 것으로 해석 할 수 있다.
편광현미경을 통해 관찰한 백색병소는 표면이 거칠고 다공성인 진행성 병소의 모습을 보였다. Light Bond™와 Transbond™를 적용한 표면을 관찰한 결과 잔존하는 프라이머의 하방은 비교적 우식으로부터 안전하였다. 아무 처리를 하지 않은 오른쪽 부위에서는 우식 양상이 관찰되었으나 그 양상은 서로 차이가 있었다. Light bond™가 적용된 인접부위에서는 재광화 양상을 보였고, Transbond™의 인접부위에서는 깊은 병소 영역만이 나타났다. 즉, 불소를 함유하지 않은 프라이머를 적용한 시편에는 우식 예방효과를 관찰 할 수 없었다. 반면 불소를 함유한 Light bond™는 우식 환경에서 하방의 법랑질이 탈회되는 것을 보호하고 인접 부위에 재광화 효과가 있음을 알 수 있었다.
다양한 연구에서 불소를 함유하는 프라이머의 효과에 대해 상반된 결과를 보고하고 있다[21,22]. 불소 방출이 초반에는 많다가 18 - 24개월에 이르는 교정치료 기간이 지나면 아주 미미하거나 없어지기 때문이다[8,17,23]. Banks와 Richmond[24]는 브라켓 부착 전에 불소 함유 프라이머를 도포하여 탈회 예방 효과가 있는 것으로 보고하였다. 즉 산부식 된 치면에 도포된 프라이머가 인공탈회용액이 치면을 부식시키지 못하게 하는 방어막으로 작용한 것으로 사료된다. 따라서 브라켓 접착 시 산부식 된 치면 전체를 프라이머로 도포하는 것이 탈회예방에 도움이 되리라 여겨진다. 또한 Benson[25]은 불소 이온이 불소를 함유하는 재료에서 방출되어 다른 부위로 옮겨 가는 것을 설명하였다. 이는 프라이머가 적용된 법랑질의 직하방 뿐만 아니라 인접부위 법랑질에도 항우식 효과가 있음을 뒷받침해준다. 특히 교정치료 후 나타나는 법랑질 탈회 현상은 거의 브라켓 하방의 치은 쪽에서 나타나므로 치은 쪽의 프라이머 도포는 탈회 예방에 많은 도움이 되리라 생각된다[26,27].
본 연구 결과 교정환자에서 고정식 장치를 부착할 때 불소를 함유하는 교정용 프라이머를 사용하면 항우식 및 재광화 효과가 있음이 밝혀졌다. 프라이머를 브라켓 베이스 면적을 포함하여 보다 넓게 주변으로 적용하여 치아 표면을 치태 내 산 생성 미생물의 공격으로부터 보호하였다. 이번 연구의 한계는 생체 외 실험으로서 실제 구강 내 환경을 재현하지 못하여 충분한 불소의 재광화 기전을 평가 할 수 없었다. 그럼에도 불구하고 본 실험에서 불소를 함유 프라이머는 법랑질 표면에서 오랜 기간 잔존하여 인접 법랑질 부위까지 탈회 예방 및 재광화 효과가 있음을 증명하고 있다. 추후의 연구는 불소를 함유한 프라이머의 탈회 및 재광화가 일어나는 양상에 대한 무기물의 조성변화, 불소 침투 깊이와 같은 더 객관적인 측정을 통한 분석이 필요하다고 생각된다.
Ⅴ. 결 론
본 연구에서는 불소를 함유한 교정용 프라이머와 불소를 함유하지 않은 프라이머에서 우식 양상을 비교하여 유의한 결과를 보였다. Light Bond™는 highly filled fluoride-releasing orthodontic primer로써 칫솔질이나 산성 환경에서도 충분한 마모저항성을 가지며, 프라이머에 함유된 불소는 항우식 및 재광화 작용으로 법랑질 탈회의 발생을 줄여준다. 즉, Light Bond™는 법랑질 보호막의 역할과 불소의 항우식 효과가 있어 브라켓 주위에 발생되는 법랑질 탈회의 유의한 감소를 가져 왔음을 확인하였다.

