단일클론항체를 사용한 타액 내 Streptococcus mutans 검출
Detection of Streptococcus mutans in Saliva using Monoclonal Antibodies
Article information
Abstract
본 연구의 목적은 Streptococcus mutans의 Ag I/II와 glucosyltransferase에 대해 개발된 단일클론항체를 사용한 타액 내 Streptococcus mutans 검출의 효용성을 평가하기 위함이다. 세 군(성인, 미성년자, 그리고 교정치료중인 미성년자)을 대상으로 DMFT, Dentocult®-SM strip mutans를 이용한 타액내의 colony density (CFU/mL), polymerase chain reaction을 이용한 Sreptococcus mutans와 Sreptococcus sobrinus의 존재여부, 그리고 4가지 단일클론항체를 사용한 타액 내 Streptococcus mutans 검출 실험을 시행하였다. 그 결과 Streptococcus mutans가 Streptococcus sobrinus보다 치아 우식 형성에 더 주요하게 작용한다는 것을 입증하였으며, glucosyltransferases (gtf B, gtf C, gtf D)와 Ag I/II에 대한 단일클론항체들의 Streptococcus mutans를 검출해 내는 능력이 Dentocult®-SM strip mutans나 polymerase chain reaction을 사용한 검출법보다 뛰어남을 보였다.
Trans Abstract
The purpose of this study was to determine the usefulness of a detection method for Streptococcus mutans in saliva with monoclonal antibodies developed targeting Ag I/II and glucosyltransferases (gtf B, gtf C and gtf D) in Streptococcus mutans. In the three groups tested (adults, minors, and minors under orthodontic treatment), the results of the DMFT scores, the colony density (CFU/mL) in their saliva was measured using Dentocult®-SM strip mutans, polymerase chain reaction was performed to test whether Streptococcus mutans and Streptococcus mutans were present, and Streptococcus mutans detecting tests performed in their saliva using four types of monoclonal antibody were collected.
In conclusion, it was demonstrated that the Streptococcus mutans plays more important role in forming dental caries compared to Streptococcus sobrinus, and that the monoclonal antibodies against glucosyltransferases (gtf B, gtf C, gtf D) and Ag I/II of Streptococcus mutans are superior in detecting Streptococcus mutans to Dentocult®-SM strip mutans or polymerase chain reaction.
Ⅰ. 서 론
치아우식증은 구강 건강과 관련하여 전 세계적으로 문제가 되고 있는 구강질환으로서 세계보건기구(WHO)의 보고에 따르면 치아우식증은 세계 인구의 약 60%에서 발병하는 것으로 보고되었다[1]. 우리나라의 경우 2012년 국민구강건강실태조사 자료를 분석한 결과, 치아우식경험지수(DMFT ; Decayed, Missing, and Filled teeth)가 점차 감소되어가는 추세이나 여전히 치아우식증은 구강건강을 위협하는 대표적인 질환이다[2].
Keyes와 Jordan[3]은 치아우식증의 발생요인을 세균, 당분, 숙주 인자로 구분하여 이들이 모두 관여하여 중복될 때 우식이 발생한다고 설명하였다. 그 후 우식이 만성질환인 점을 감안하여 이들에 제4의 인자인 시간을 포함시켰고, 지속적인 연구를 통해 치아우식증의 병인으로 환경적 여러 요인들이 고려되면서 우식병인론의 또 다른 모델이 제시되고 있다[4].
이와 같이 다양한 인자들이 관여하는 치아우식증의 일차적 원인은 치면세균막 내에 존재하는 세균으로 알려져 있으며, 실제 구강에서 치태를 이루는 세균들이 존재하지 않는다면 우식은 발생하지 않는다[5]. 치아우식증은 치면세균막 내에 존재하는 세균들의 당질 대사산물인 젖산 등의 유기산에 의해 치아의 법랑질이 탈회되면서 발생하는데, 이러한 세균들로는 Streptococcus mutans (S. mutans)와 Streptococcus sobrinus (S. sobrinus)를 포함하는 mutans streptococci가 있으며, 그 중 S. mutans가 우식병소를 유발하는 가장 주요한 세균이라는 것이 밝혀졌다[6].
치아우식증의 발병론은 3가지 단계가 제시되고 있는데, 그 첫 단계는 sucrose-독립 단계로 S. mutans는 S. mutans의 표면 항원 단백질인 Ag I/II에 의해 치면 세균막에 부착한다. 두 번째 단계는 sucrose-종속 단계로 섭취된 sucrose를 이용하여 S. mutans가 생성하는 glucosyltransferase (gtfs)에 의해 접착성이 강한 glucan이 형성되어 glycocalyx가 만들어지고, 세균의 glucan binding proteins (GBP)에 의해 다른 세균들과 집락을 이루어, 치아 표면에 붙는 S. mutans의 수가 점점 증가한다. 세 번째 단계로 축적된 치태 내 세균이 산을 생성하고, 유리된 산이 치아를 탈회시켜 치아우식증을 야기하게 된다[7].
이 중 세균이 치면에 부착하는 것은 치아 우식증이 발생하는 첫 번째 단계로 이 모든 일련의 과정이 시작되는 가장 중요한 단계라 할 수 있다. 따라서 S. mutans의 독성인자를 대상 항원으로 한 연구가 많이 진행 중이며, 특히 세균의 부착에 관여하는 단백질인 Ag I/Ⅱ, gtfs, GBP에 집중하여, 최근 실제로 이것을 이용해 우식 예방에 효과를 거둔 연구들이 발표되고 있다[8].
이 연구에서는 S. mutans의 표면에 발현되어 독성을 나타내는 Ag I/II 단백질과 S. mutans가 생성하여 치태를 만드는 gtfs에 대하여 개발된 단일클론항체들을 가지고, 이들을 타액에 적용했을 때 단일클론항체들이 S. mutans를 검출해 내는 능력을 확인하고자, DMFT와 Dentocult®-SM strip mutans를 이용한 colony density, 그리고 polymerase chain reaction(PCR) 등을 조사하여 비교하였다.
Ⅱ. 연구 재료 및 방법
본 연구는 전북대학교병원의 임상 연구 윤리 위원회(Institutional Review Board, IRB)의 지침에 따라 수립하였으며, 심의 절차 과정을 통과하였다(IRB번호 : 2011-07-025-001).
1. 조사 대상
이 연구는 S. mutans와 치아우식 간의 유의적 연관성에 대해 알아보고자 세 군을 대상으로 시행되었다. 성인과 미성년자의 차이를 평가하기 위해 각각을 다른 군으로 나누어 실험 대상자로 설정하였으며, 교정 치료 유무에 따른 차이를 알아보기 위해 교정 치료 중인 미성년자 한 군을 더하여 최종 실험 대상자를 세 군으로 설정하였다. 미성년자인 실험 대상자들은 실험 결과의 안정성과 DMFT를 얻기 위해 만 10세 이상만 실험에 참여하였다. 1군은 전북대학교 치과병원 소아치과에서 교정 치료 중인 환자들 중, 특별한 의과적 병력이 없는 만 10세 이상의 교정 환자 31명(만 13.5세, 남녀 16 : 15), 2군는 특별한 의과적 및 치과적 병력이 없는 만 10세 이상의 전주시 초등학교 5학년 학생 25명(만 10.2세, 남녀 11 : 14), 그리고 3군은 특별한 의과적 병력이 없는 20~30대 성인 41명(만 28.4세, 남녀 25 : 16)을 대상으로 하였다. 이 연구를 위해 총 97명의 피실험자가 참여하였다.
연구 대상자들은 구강 검사 전에 식사를 한 후 칫솔질을 하지 않고 실험에 참여하였다. 동일한 검사자에 의한 구강 검사 후, 우식경험치아수가 기록되었고, 파라핀 왁스를 사용하여 자극성 타액을 10~15 mL씩 채취하였으며, 채취된 타액은 검사 시작 전까지 -20℃에 보관하였다. 실험 대상자에게 실험의 목적과 방법을 상세하게 설명하고 동의를 얻었으며, 대상자가 미성년자인 경우에는 보호자에게도 동의를 얻은 후 연구를 진행하였다.
2. 조사 방법
1) 치아우식경험지수(DMFT)
연구 대상자의 구강상태를 조사하기 위하여 동일한 검사자(치과의사)가 치경과 탐침을 이용하여 조사하였다. 세계보건기구에서 제시한 지표를 기준으로 상하좌우 제3대구치를 제외한 28개의 치아를 대상으로 우식치아, 상실치아, 충전치아를 조사하여 DMFT를 산정하였다. 우식치아는 international caries detection and assessment system (ICDAS)를 기준으로 grade 0에 해당하는 백색반점 또는 백묵양반점 등의 초기 치아 우식증의 치아는 건전치아로 판정하였다[9].
2) Dentocult®-SM strip mutans를 이용한 colony density (CFU/mL)
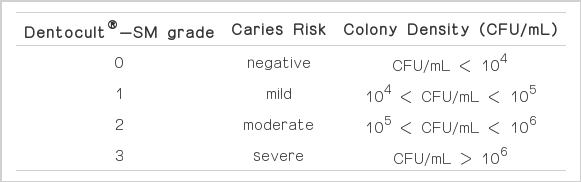
Dentocult®-SM strip mutans (Orion Diagnostica, Espoo, Finland)내의 파라핀을 수 분간 씹게 하여 타액을 수집 후 배지판을 혀에 대고 screening strip 전체면에 타액이 충분히 묻도록 한다. 미리 bacitracin disc를 녹인 배양액에 넣어 마개를 조금 느슨하게 잠근 후, 37℃ 항온 배양기에서 48시간 배양하여 제작회사의 판정표의 기준에 의한 S. mutans의 집락 수에 따라, 우식활성도를 grade 0~3으로 판정하였다(Table 1).
3) PCR을 이용한 S. mutans와 S. sobrinus의 존재여부
타액 내 S. mutans와 S. sobrinus의 존재여부는 PCR 실험을 통해 확인하였다. 실험에 사용된 primer는 5-GATAACTACCTGACAGCTGACT-3'과 5'-AAGCTGCCTTAAGGTAATCACT-3'이 S. sobrinus에 대해 사용되었으며, 5'-ATGCGCAATCAACAGGTT-3'과 5-CGCAACGCGAACATCTTGATCAG-3'이 S. mutans를 위해 사용되었다. PCR실험을 위한 총 양은 20 μL로 DNA 1 μL와 5 × PCR mixture (ELPIS, Taejeon, Korea) 4 μL, 5 pM primer 1 μL, 증류수 14 μL로 이루어졌다. PCR 반응은 95℃에서 1분간 denaturation 후, 95℃에서 10초간 denaturation, 58℃에서 10초간 annealing, 72℃에서 10초간 extension 과정을 30cycle 수행하였으며, 그 후 72℃에서 5분간 extension 하였다. PCR 실험을 통해 나온 산물은 1% 아가로즈 젤에서 분석되었다.
4) 4가지 단일클론항체를 사용한 타액 내의 S. mutans 검출
(1) 4가지 단일클론항체의 개발
이 실험에 사용된 S. mutans의 Ag I/II 단백질과 gtfs (gtf B, gtf C, gtf D)에 대한 단일클론항체는 기존에 제작된 항체들을 사용하였다. 이 항체들을 얻기 위해서 Ag I/II 단백질과 gtfs(gtf B, gtf C, gtf D)의 N-terminus 유전자를 PCR을 통해 증폭하였다. 이를 T 벡터에 ligation하여 sequencing을 통해 정확한 sequence를 가진 벡터를 선택하여 제한효소로 잘라 plasmid에 integration하여 얻어진 벡터를 이용해 재조합 단백질들(Ag I/II-N, gtfBN, gtfCN, gtfDN)을 발현시켰고, 이를 확인하였다. 이 단백질들을 정제하여 mice에 주입하였으며, 얻어진 spleen cell을 SP2/0 cell과 fusion하여 hybridoma를 생성하였다. Western blot과 Dot blot, 그리고 ELISA를 통해 이 hybridoma가 Ag I/II-N, gtfBN, gtfCN, gtfDN에 대한 단일클론항체 anti-Ag I/II antibody, anti-gtfBN antibody, anti-gtfCN antibody, anti-gtfDN antibody (ckAg I/II, ckBN, ckCN, ckDN)를 생성함을 확인하였다.
(2) 4가지 단일클론항체를 사용한 타액 내의 S. mutans 검출
타액 내 S. mutans를 검출하기 위해 enzyme-linked immunosorbent assay (ELISA) 실험방법을 사용하였다. ELISA 실험을 위해 20 μL의 재조합 Ag I/II 단백질과 gtfs(gtf B, gtf C, gtf D)로 코팅한 96-well 플레이트(Nunc, Roskilde, Denmark)에 100 μL의 타액을 넣은 후 4℃에서 하루 저녁 놓아두었다. 이것을 3% skim milk로 상온에서 30분 차단시킨 다음 phosphate buffered saline (PBS)로 3번 씻은 후 각 단일항체를 넣어 37℃에서 1시간 incubation하였다. PBS로 씻어 항체 제거 후 alkaline phosphate가 붙은 goat anti-mouse immunoglobulin G (Sigma Chemical Co., St. Louis, MO, USA)를 37℃에서 1시간 incubation하였다. 이것을 PBS로 4번 씻은 후 alkaline phosphatase substrate를 넣어, ELISA reader (Packard Instrument Co., Downers Grove, IL, USA)기에서 405 nm로 측정하였다.
5) 통계 분석
각 연구 대상자들의 DMFT와 Dentocult®-SM strip mutans, PCR을 이용한 S. mutans와 S. sobrinus의 존재유무, 그리고 4가지의 단일클론항체를 사용한 타액 내의 S. mutans 검출실험의 자료를 SPSS (Statistical Package for Social Science) Ver 19.0 통계 프로그램을 사용하여 분석하였다. 각 군들의 DMFT, Dentocult®-SM strip mutans, S. mutans와 S. sobrinus의 PCR 결과, 그리고 S. mutans와 4가지의 단일 클론항체 반응 간의 상관관계를 살펴보기 위해 Spearman 상관분석을 실시하였으며, 군에 따른 각 실험 결과들의 차이에 대해 Chi-square 검정, One-way ANOVA를 실시하였다. 비모수적인 방법으로 Fisher’s Exact test, Kruskal-Wallis test를 실시하였다.
Ⅲ. 연구 성적
1. 치아우식경험지수(DMFT)
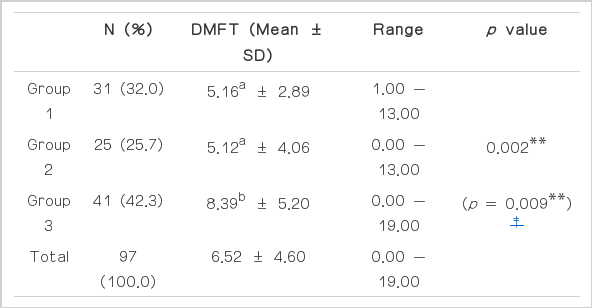
조사대상자의 표본 구성과 특성을 살펴보기 위해 빈도분석을 실시한 결과 Table 2와 같이 나타났다. 연구 대상자는 총 97명이었으며, 1군 교정환자 32.0%, 2군 초등학생 25.8%, 3군 성인 42.3%이었고, 각 군의 DMFT는 5.16, 5.12, 8.39로 나타났으며, 전체 DMFT 평균은 6.52로 조사되었다(Table 2).
2. Dentocult®-SM strip mutans를 이용한 colony density (CFU/mL)
1군의 Dentocult®-SM strip mutans를 이용한 colony density (CFU/mL) 조사에서 grade 0이 10명(32.3%), grade 1이 16명(51.6%), grade 2가 4명(12.9%), grade 3이 1명(3.2%)으로 나타났으며, 2군는 grade 0이 11명(44.0%), grade 1이 11명(44.0%), grade 2가 2명(8.0%), grade 3이 1명(4.0%)으로 나타났고, 3군은 grade 0이 18명(43.9%), grade 1이 16명(39.0%), grade 2가 6명(14.6%), grade 3이 1명(2.4%)으로 나타났다. 전체 연구대상자의 Dentocult®-SM strip mutans는 grade 0이 39명(40.2%), grade 1이 43명(44.3%), grade 2가 12명(12.4%), grade 3이 3명(3.1%)으로 나타났다(Table 3).
3. PCR을 이용한 S. mutans와 S. sobrinus의 존재여부
1군의 타액을 이용한 S. mutans에 대한 PCR 결과, S. mutans가 검출되지 않은 경우가 61.29%, 검출된 경우가 38.71%로 나타났으며, S. sobrinus에 대한 PCR 결과는 S. sobrinus가 검출되지 않은 경우가 58.65%, 검출된 경우가 41.94%로 나타났고, S. mutans와 S. sobrinus가 공통으로 검출된 경우는 80.65%, 둘 다 검출되지 않은 경우는 19.35%로 나타났다. 2군의 타액을 이용한 S. mutans에 대한 PCR 결과, S. mutans가 검출되지 않은 경우가 44%, 검출된 경우가 56%로 나타났으며, S. sobrinus에 대한 PCR 결과는 S. sobrinus가 검출되지 않은 경우가 36%, 검출된 경우가 64%로 나타났고, S. mutans와 S. sobrinus가 공통으로 검출된 경우는 72%, 둘 다 검출되지 않은 경우는 28%로 나타났다. 3군의 타액을 이용한 S. mutans에 대한 PCR 결과, S. mutans가 검출되지 않은 경우가 41.46%, 검출된 경우가 58.54%로 나타났으며, S. sobrinus에 대한 PCR 결과는 S. sobrinus가 검출되지 않은 경우가 65.85%, 검출된 경우가 34.15%로 나타났고, S. mutans와 S. sobrinus가 공통으로 검출된 경우는 73.17%, 둘 다 검출되지 않은 경우는 26.83%로 나타났다. 전체 연구대상자들의 S. mutans에 대한 PCR 결과, S. mutans가 검출되지 않은 경우가 48.5%, 검출된 경우가 51.5%로 나타났으며, S. sobrinus에 대한 PCR 결과는 S. sobrinus가 검출되지 않은 경우가 55.7%, 검출된 경우가 44.3%로 나타났고, S. mutans와 S. sobrinus가 공통으로 검출된 경우는 24.7%, 둘 다 검출되지 않은 경우는 75.3%로 나타났다(Fig. 1-3, Table 4).
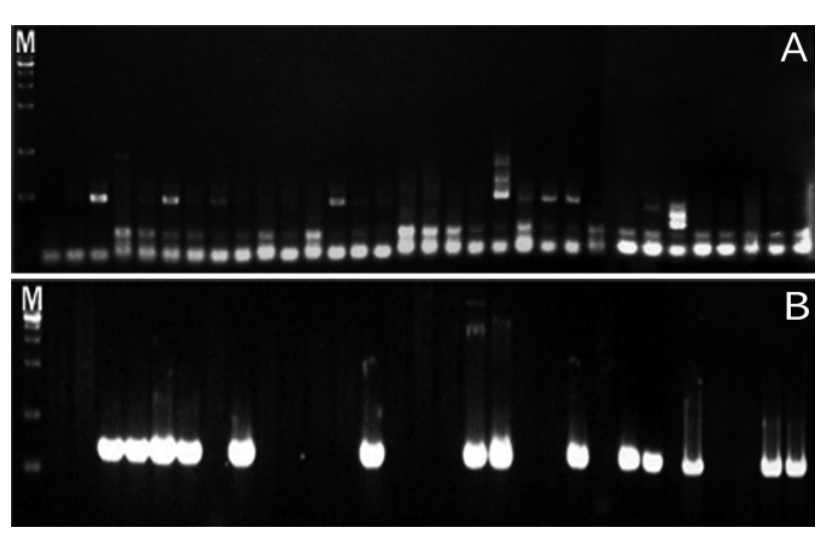
Representative results from the electrophoresis of polymerase chain reaction using Streptococcus mutans and Streptococcus sobrinus in saliva samples of group 1. (A) Streptococcus mutans. (B) Streptococcus sobrinus. (M : marker, lane 1-31 : products of polymerase chain reaction of group 1).
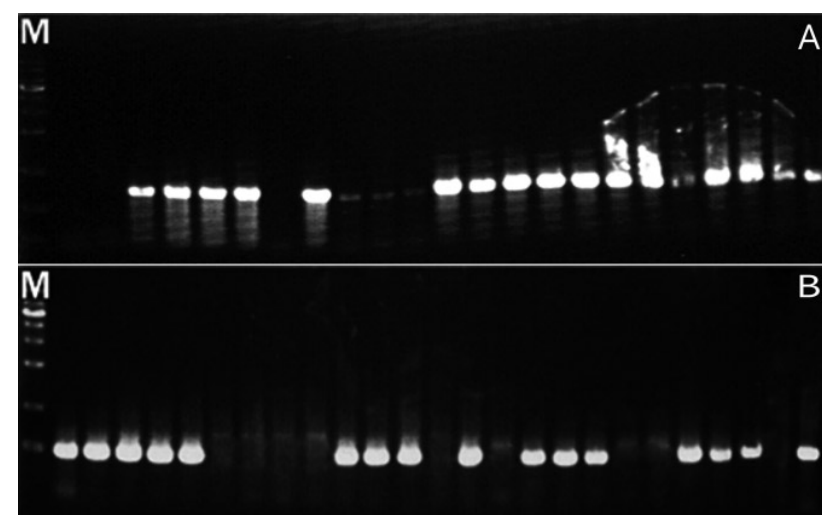
Representative results from the electrophoresis of polymerase chain reaction using Streptococcus mutans and Streptococcus sobrinus in saliva samples of group 2. (A) Streptococcus mutans. (B) Streptococcus sobrinus. (M : marker, lane 1-25 : products of polymerase chain reaction of group 1).
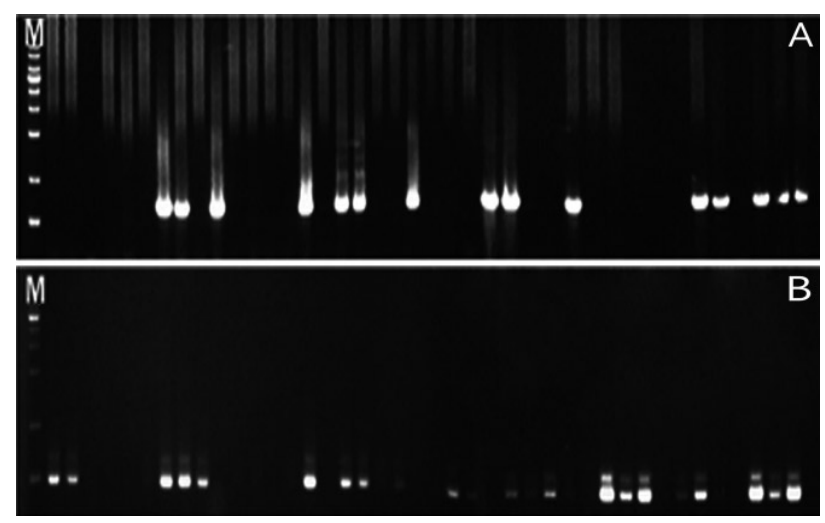
Representative results from the electrophoresis of polymerase chain reaction using Streptococcus mutans and Streptococcus sobrinus in saliva samples of group 3. (A) Streptococcus mutans. (B) Streptococcus sobrinus. (M : marker, lane 1-41 : products of polymerase chain reaction of group 1).
4. 4가지의 단일클론항체를 사용한 타액 내의 S. mutans 검출
ELISA를 사용하여 타액과 개발된 4가지 단일클론항체(ckAg I/II, ckBN, ckCN, ckDN)를 반응시켜 타액 내 S. mutans를 검출하였다. 1군에서 ckAg I/II은 평균 1.78, ckBN은 평균 1.97, ckCN은 평균 1.86, ckDN은 평균 1.55로 검출되었으며, 2군에서 ckAg I/II은 평균 1.70, ckBN은 평균 1.82, ckCN은 평균 1.57, ckDN은 평균 1.70로 검출되었고, 3군에서 ckAg I/II은 평균 1.65, ckBN은 평균 1.67, ckCN은 평균 1.44, ckDN은 평균 1.44로 검출되었다. 전체 연구대상자들에서는 ckAg I/II은 평균 1.71, ckBN은 평균 1.80, ckCN은 평균 1.61, ckDN은 평균 1.54로 검출되었다(Fig. 4-6, Table 5).
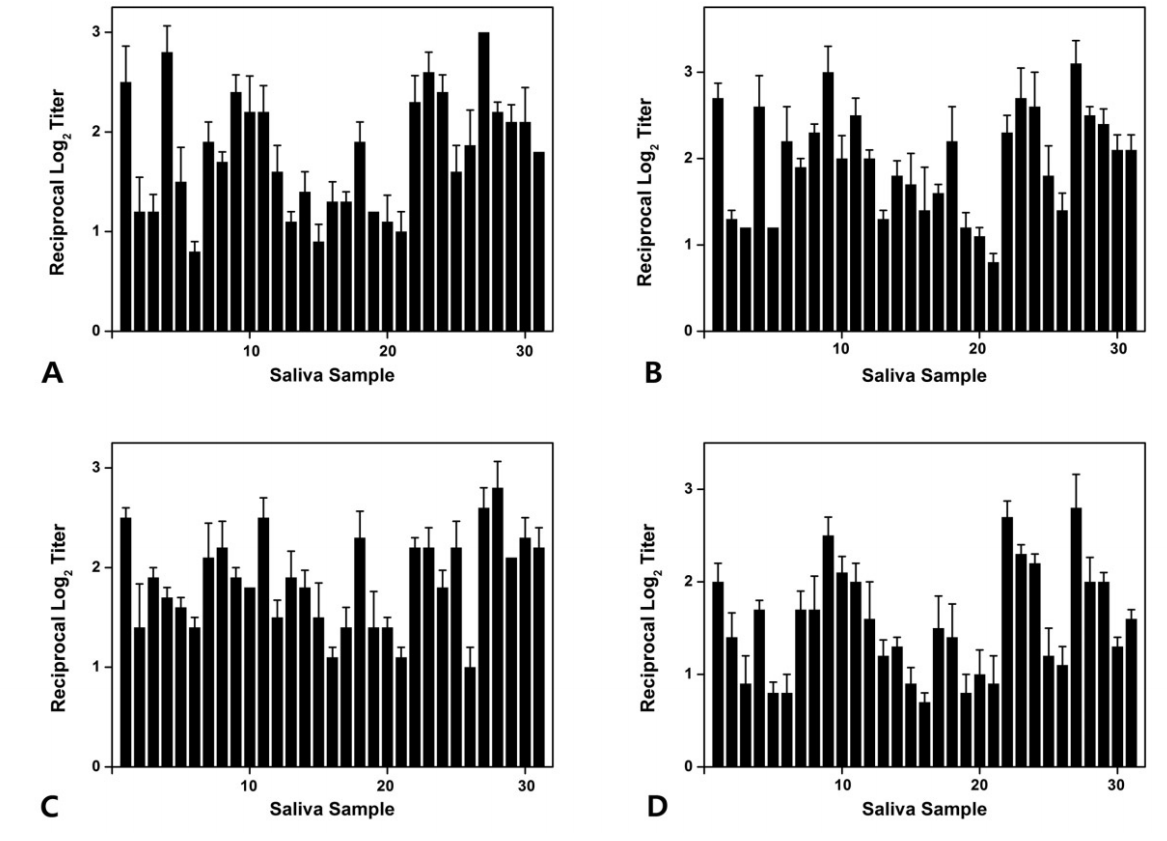
Level of antibodies (A) ckAg I/II, (B) ckBN, (C) ckCN, (D) ckDN identified by enzyme-linked immunosorbent assay (ELISA) in saliva samples of group 1.
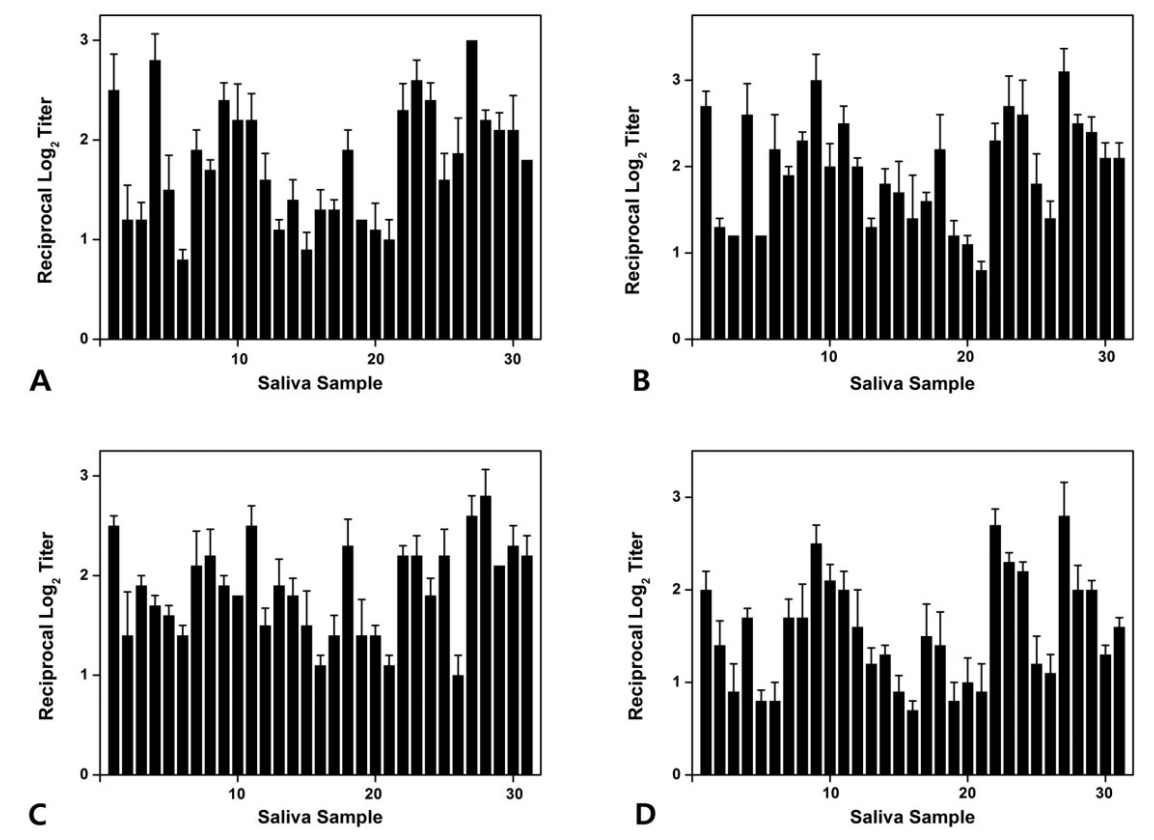
Level of antibodies (A) ckAg I/II, (B) ckBN, (C) ckCN, (D) ckDN identified by enzyme-linked immunosorbent assay (ELISA) in saliva samples of group 2.

Level of antibodies (A) ckAg I/II, (B) ckBN, (C) ckCN, (D) ckDN identified by enzyme-linked immunosorbent assay (ELISA) in saliva samples of group 3.
5. 변수 간 상관분석
1) 전체의 변수 간 상관분석
본 연구의 변수 간 관련성을 살펴보기 위하여 Spearman 상관분석을 시행한 결과, Dentocult®-SM strip mutans (DSM)를 이용한 실험은 polymerase chain reaction-Streptococcus mutans (PCR-SM) (r = 0.295, p < 0.01), polymerase chain reaction-Streptococcus sobrinus (PCR-SS) (r = 0.369, p < 0.001), PCR-Both (r = 0.467, p < 0.001)에 양(+)의 유의한 영향이 있는 것으로 나타났다. PCR-SM은 PCR-Both (r = 0.585, p < 0.001)에 양(+)의 유의한 영향이 있는 것으로 나타났으며, PCR-SS는 PCR-Both (r =0.643, p < 0.001)에 양(+)의 유의한 영향이 있는 것으로 나타났다. ckAg I/II level은 ckBN (r = 0.811, p < 0.001), ckCN (r = 0.753, p < 0.001), ckDN (r = 0.834, p < 0.001)에 양(+)의 유의한 영향이 있는 것으로 나타났으며, ckBN은 ckCN (r = 0.823, p < 0.001), ckDN (r = 0.825, p < 0.001)에 양(+)의 유의한 영향이 있는 것으로 나타났고, ckCN은 ckDN (r = 0.751, p < 0.001)에 양(+)의 유의한 영향이 있는 것으로 나타났다.
2) 1군의 변수 간 상관분석
1군의 변수 간 관련성을 살펴보기 위하여 Spearman 상관분석을 시행한 결과, D-SM을 이용한 실험은 PCR-SM (r = 0.510, p < 0.01), PCR-Both (r = 0.492, p < 0.01)에 양(+)의 유의한 영향이 있는 것으로 나타났다. PCR-SM은 PCR-Both (r = 0.661, p < 0.001)에 양(+)의 유의한 영향이 있는 것으로 나타났으며, ckAg I/II (r = - 0.554, p < 0.01), ckBN (r = - 0.534, p < 0.01), ckDN (r = - 0.434, p < 0.05)에 음(-)의 유의한 영향이 있는 것으로 나타났고, PCR-SS는 PCR-Both (r = 0.576, p < 0.01)에 양(+)의 유의한 영향이 있는 것으로 나타났다. ckAg I/II는 ckBN (r = 0.841, p < 0.001), ckCN (r = 0.629, p < 0.001), ckDN (r = 0.853, p < 0.001)에 양(+)의 유의한 영향이 있는 것으로 나타났으며, ckBN은 ckCN (r = 0.662, p < 0.001), ckDN (r = 0.822, p < 0.001)에 양(+)의 유의한 영향이 있는 것으로 나타났고, ckCN은 ckDN (r = 0.614, p < 0.001)에 양(+)의 유의한 영향이 있는 것으로 나타났다.
3) 2군의 변수 간 상관분석
2군의 변수 간 관련성을 살펴보기 위하여 Spearman 상관분석을 시행한 결과, DMFT는 D-SM (r = 0.416, p < 0.05)에 양(+)의 유의한 영향이 있는 것으로 나타났으며, D-SM은 PCR-SS (r = 0.460, p < 0.05), PCR-Both (r = 0.576, p < 0.01), ckAg I/II (r = 0.488, p < 0.05)에 양(+)의 유의한 영향이 있는 것으로 나타났다. PCR-SM은 PCR-Both (r = 0.599, p < 0.01), ckBN (r = 0.433, p < 0.05)에 양(+)의 유의한 영향이 있는 것으로 나타났으며, PCR-SS는 PCR-Both (r = 0.509, p < 0.01)에 양(+)의 유의한 영향이 있는 것으로 나타났고, PCR-Both는 ckBN (r = 0.494, p < 0.05)에 양(+)의 유의한 영향이 있는 것으로 나타났다. ckAg I/II는 ckBN (r = 0.686, p < 0.001), ckCN (r = 0.723, p < 0.001), ckDN (r = 0.688, p < 0.001)에 양(+)의 유의한 영향이 있는 것으로 나타났으며, ckBN은 ckCN (r = 0.781, p < 0.001), ckDN (r = 0.801, p < 0.001)에 양(+)의 유의한 영향이 있는 것으로 나타났고, ckCN은 ckDN (r = 0.676, p < 0.001)에 양(+)의 유의한 영향이 있는 것으로 나타났다.
4) 3군의 변수 간 상관분석
3군의 변수 간 관련성을 살펴보기 위하여 Spearman 상관분석을 시행한 결과, D-SM은 PCR-SM (r = 0.453, p < 0.01), PCR-SS (r = 0.417, p < 0.01), PCR-Both (r = 0.514, p < 0.01)에 양(+)의 유의한 영향이 있는 것으로 나타났다. PCR-SM은 PCR-Both (r = 0.528, p < 0.001)에 양(+)의 유의한 영향이 있는 것으로 나타났으며, PCR-SS는 PCR-Both (r = 0.797, p < 0.001)에 양(+)의 유의한 영향이 있는 것으로 나타났다. ckAg I/II는 ckBN (r = 0.856, p < 0.001), ckCN (r = 0.902, p < 0.001), ckDN (r = 0.885, p < 0.001)에 양(+)의 유의한 영향이 있는 것으로 나타났으며, ckBN은 ckCN (r = 0.933, p < 0.001), ckDN (r = 0.868, p < 0.001)에 양(+)의 유의한 영향이 있는 것으로 나타났고, ckCN은 ckDN (r = 0.922, p < 0.001)에 양(+)의 유의한 영향이 있는 것으로 나타났다.
6. 군에 따른 변수의 차이비교
군에 따른 변수들의 차이를 살펴보기 위해 Chi-square 검정, One-way ANOVA를 실시한 결과, 군에 따라 DMFT, PCR-SM, ckCN에서 통계적으로 유의한 차이가 있는 것으로 나타났으며(p < 0.05), 비모수적 방법인 Fisher’s Exact test, Kruskal-Wallis test를 시행한 결과 DMFT, PCR-SM, ckCN에서 통계적으로 유의한 차이가 있는 것으로 나타났다(p < 0.05). DMFT에서 3군(Mean = 8.39)이 1군(Mean = 5.16), 2군(Mean = 5.12)보다 높은 것으로 나타났다. PCR-SM는 1군에서 불검출 61.3%, 2군에서 검출 52.0%, 3군에서 검출 48.8%로 높게 나타났다. ckCN에서 1군(Mean = 1.86)이 2군(Mean = 1.57), 3군(Mean = 1.44)보다 높은 것으로 나타났다.
Ⅳ. 총괄 및 고찰
치아 우식의 해결과 예방을 위하여 그동안 많은 연구들이 이루어졌다. 우식 형성 요인들 중, 미생물은 가장 중요한 인자로 여겨진다. 사람에서 많이 발견되는 치아우식균으로는 S. mutans와 S. sorbinus가 있으며, 이 두 세균이 동시에 출현할 경우, 타액 내 mutans streptococci의 수가 높게 나타나고[10] 치아우식증이 더 심하게 나타나는 경향이 있다[11]. 그 중 S. mutans가 S. sorbinus에 비해, 세균이 치아에 처음 부착할 때 요구되는 특별한 세포 표면 단백질이 풍부하기 때문에 우식 형성능이 더 크다고 밝혀졌다[12].
S. mutans의 초기 부착은 세포 표면의 부착 단백질(AgⅠ/Ⅱ)에 의해 이루어진다. 이 단백질은 세균이 치아 표면에 부착하는 것을 돕고, 더 많은 부착이 이루어지도록 부착부위를 제공하기도 한다[13]. 최근의 연구에서, 이 단백질을 억제시키자 S. mutans의 독성이 감소되었다[14]. 치면에 초기 부착 후, S. mutans는 sucrose를 이용하여 수용성과 불수용성의 glucan을 합성하는데, 이러한 과정은 gtfs 효소(gtf-B, gtf-C, gtf-D)에 의해 이루어진다. 이 효소들은 glucan 합성의 마지막에 글루코실기 일부를 전이시켜 덧붙이는 과정을 촉진하고, 이렇게 만들어진 글루칸의 점착성은 치아에 세균의 부착을 용이하게 한다. 그리고 S. mutans는 글루칸과 결합하는 단백질들(GBPs)을 만드는데, 이것은 sucrose-dependent 단계에서 세균의 부착을 돕는다[15]. 또한 S. mutans는 fructosyltransferase (FTF)를 이용하여 fructan을 합성하는데, fructan은 세포외 저장고로서의 역할을 하는 것으로 여겨지며, 치태생성에 관여하는 것으로 알려져 있다[16]. 세포외 glucose와 sucrose가 있을 때 S. mutans는 glycogen과 비슷한 세포내 다당류(innerpolysaccharides, IPSs)를 만드는데, 이것은 외부에 탄수화물이 없을 때 대사되어 산의 생성을 유도한다[15]. S. mutans의 세포막에 있는 ATPase는 세균으로부터 H+이온의 pumping을 도와 세포 내 산성화를 감소시켜 주위의 낮은 pH환경에서도 세균이 기능할 수 있도록 한다[17]. S. mutans의 항세균 물질인 mutacin은 다른 종류의 mutans streptococci와 mutans streptococci가 아닌 그람양성 세균들의 성장을 방해한다. 이런 과정을 통해 결국 mutacin은 구강 내에서 S. mutans가 효과적으로 정착하여 집락을 이루도록 돕는다[16]. 이러한 단계적인 치아우식증의 병인 과정을 막는 것이, 치아우식증을 예방하거나 치료하는 연구의 주요한 과제가 될 것이다.
또한 구강 내 세균의 집락 형성에는 환경적인 상호 작용이 중요하다. 자연 면역반응이 일어나더라도 과다한 탄수화물에 노출되거나 면역학적으로 이상이 있으면, mutans streptococci가 우세해 질 것이다[18]. 따라서 치아우식증을 예방하기 위해서 는 IgG를 통한 면역 반응이나 S-IgA를 이용하여 세균 집락 형성을 조절하는 것이 중요하다.
그 중 우식을 야기하는 mutans streptococci에 대한 면역 방어는 주로 타액에서 분비되는 IgA 항체에 의해 이루어지는데 이 항체는 세균의 외독소나 질병을 일으키는 효소 및 바이러스 등을 중화시키고, 산 생성을 방해하며, 치아나 구강 점막 표면에 세균이 부착하는 것을 방해한다[19]. 타액 내 항생 물질(lysozyme, lactoferrin, lactoperoxidase 등)의 효과를 더욱 증가시키는 S-IgA의 효과 때문에, S. mutans에 대한 S-IgA의 반응을 증가시키는 방향으로 백신 개발이 이루어지고 있다[20]. S. mutans의 AgⅠ/Ⅱ와 gtfs를 조합한 캡슐로 능동 면역화 한 실험에서 S-IgA 항체의 증가가 성공적으로 나타났다[21]. 그러나 능동 면역에서 야기될 수 있는 위험성 때문에, 치아우식증에 대해 수동 면역으로 구강에 적용 가능한 항체 개발이 대안으로 제시되고 있다[22]. S. mutans의 항원에 대해 개발된 항체와 유전적으로 가공된 인간화 S-IgA 항체를 이용한 연구에서, 개발된 단일클론항체를 적용했을 때, S. mutans의 재출현이 일정기간 억제되었으나 더 많은 실험참가자들을 대상으로 한 실험에서는 동일한 결과가 나타나지 않았다[23]. 하지만 이러한 연구들은 항체의 mutans streptococci 집락 형성을 방해하는 능력을 증명한 것에 큰 의의가 있으며, 향후 이를 바탕으로 단일클론항체를 이용하여 S. mutans에 의한 치태 형성 억제에 대한 연구가 요구된다.
우식 위험도가 높은 환자를 식별하고 예방하기 위해 단일클론항체를 이용하여 타액 내 S. mutans의 양을 1분 이내에 나타내는 연구가 발표되었고, 최근에는 Saliva-check™ mutans (GC, Tokyo, Japan)라는 제품도 상용화되었다[24]. 이는 S. mutans의 존재유무 판정만이 이루어진다는 점과 고비용이 한계점으로 지적되기는 하나, 세균의 배양기간이 필요하지 않기 때문에 결과를 신속하게 알 수 있으며 사용법이 간단하다는 장점이 있다[25,26]. 그 밖에도 단일클론항체와 타액 내 S. mutans를 활용하여 치아우식증을 예측하고 예방하기 위한 여러 연구들이 지속되고 있으나 아직 획기적인 상품의 개발이 이루어지지 않고 있는 것이 현실이다[27]. 따라서 치아우식증에 영향을 줄 수 있는 여러 요소들의 조절과 더 많은 연구를 통해, 경제적이고 빠르고 간편하며 정량적인 대량 검출법과 치아 우식 백신의 상용화가 이루어진다면 치아우식증을 예방하는데 있어서 상당한 도움이 될 수 있을 것으로 생각된다.
이에 본 연구에서는 S. mutans의 초기 병인론에 중요한 역할을 하는 Ag I/II 단백질과 gtfs에 대해 개발된 단일클론항체들을 사용하여, 타액 내 S. mutans를 검출하고 그들의 정략적 분석을 통해 단일클론 항체들의 효용성을 평가하며, S. mutans의 존재 여부를 확인하기 위한 측정 제품으로서의 개발 연구 가능성을 보았다. 연구 대상인 세 군에서 DMFT, Dentocult®-SM strip mutans를 이용한 colony density (CFU/mL), 그리고 PCR을 이용한 S. mutans와 S. sobrinus 존재여부의 상관관계를 조사한 결과, 전체 97개체 중 우식 경험치아수가 0인 대상은 8명이었으며 그 중 1명에서 S. mutans가 검출되었고(18%), 4명에서 S. sobrinus가 검출되었으며(50%) 나머지 3명에서는 둘 다 검출 되지 않았다(32%). 이것은 기본적으로 S. sobrinus가 치아우식 형성에 큰 영향을 주지 않는 요인임을 입증하는 것이라 할 수 있다. 세 군은 각 실험들 간의 상관성 조사에서 일부 유의한 값을 보였으나 뚜렷한 상관 관계는 확인할 수 없었는데 그 원인을 고려해 보자면, DMFT의 경우 치의학 연구 분야에서 다방면으로 이용되고 있으나 우식치아(decayed teeth, DT), 상실치아(missed teeth, MT), 충전치아(filled teeth, FT)를 합산하는 방식이기 때문에, 현재의 S. mutans 활동성을 측정하기에는 적합하지 않을 수 있으리라 생각된다. DMFS가 높거나 DT, MT, FT를 따로 관찰한 연구에서 DT가 높을수록 세균 활성이 높았다는 연구 결과를 미루어 보았을 때, DMFT가 여전히 많은 연구에서 사용되고 있으나 정확도를 높이기 위해서는 식이 조절이나 양치질 횟수 조절 등의 좀 더 엄격한 조건에서의 관찰이 필요하다[28].
단일클론항체를 사용한 타액 내 S. mutans 검출값과 DMFT, Dentocult®-SM strip mutans, PCR 결과 간의 상관관계를 조사하였을 때 실험 대상의 DMFT 평균값은 3군이 1, 2군에 비해 높았으며 1군과 2군은 비슷하였다. 이에 반해 단일클론항체에 의해 측정된 1, 2, 3군의 S. mutans는 오히려 DMFT가 높은 3군에서 전체적으로 단일항체에 의해 측정된 양이 적게 나타났다. 이것은 항체를 측정하는 방법으로 채택된 ELISA는 단일클론항체를 사용해 정확도는 높으나 특정 단백질에 대한 항체의 역가만을 측정해 전체적인 S. mutans의 양을 측정하기에는 적합하지 못하다는 것을 보여준다. 즉, 측정된 항체는 세균의 특정 항원에 대한 항체의 양이지 S. mutans 전체에 대한 항체의 양이라고 할 수 없다는 것이다[29]. 따라서 본 연구에서 S. mutans와 단일클론항체 반응시켜 얻어진 S. mutans의 정량적 양과 Dentocult®-SM strip mutans나 PCR 결과 간의 유의적 연관성을 유추하기가 어려웠다. 그러므로 S. mutans의 전체적인 양 측정을 위해서 보다 많은 S. mutans에 대한 항체 개발 연구가 필요하며 그에 따라 단일 항체 모두를 이용한 S. mutans의 측정 실험도 수행되어져야 할 것으로 보인다.
또한 타액 채취 시 구강의 환경 요인을 생각해 볼 수 있다. 만일 치아우식증의 발생에 단지 치면세균막을 형성할 수 있는 미생물 요인만이 그 원인이 된다면 한 가지 검사만으로 충분히 개개인의 우식 발생을 예견하고 예방할 수가 있겠으나, 미생물 요인 이외에도 다른 수많은 요인들이 복합적으로 상호작용을 일으키는 구강 환경들로 인해, 본 실험에서는 앞서 언급한 것 이외에는 군을 나누어 조사한 것에 대하여 큰 의미 있는 결과를 도출하지 못했다. 연구대상자들의 타액 채취 전, 구내 조건을 동일하게 설정하기 위해 칫솔질을 제한하였으나, 그 이외의 조건들은 통제하거나 조절하지 못했다. 또한 3군의 경우 더 유의한 상관성이 관찰되지 않은 것은 성인은 일차 우식보다는 이차 우식이 더 많아 우식발병 기전이 아이들보다 더 복잡하고, 담배나 복용 약품, 그리고 타액 흐름 등이 성인의 구강 환경에 더 영향을 주었기 때문이라 여겨진다[30]. 채취 시간에 따라 S. mutans의 수가 달랐다는 연구도 있어 이 또한 제한되어야 하는 요인으로 사료된다. 여러 연구들에서 치아우식증의 발생을 위해서는 미생물, 식이, 시간뿐만 아니라, 사회, 행동 요인 같은 환경 및 구강검사결과 등의 다양한 요인이 고려되어야 한다고 주장하였다[31]. 치아우식증을 예측하는 데 있어 미생물 요인이 가장 영향력 있는 인자이기는 하나, 다른 요인들에 의해 치아우식증의 정도가 가감될 수 있는 것이기에 차후 단일클론항체를 이용한 S. mutans의 측정량과 DMFT와의 유의적 연관성을 찾기 위한 실험에서는 연구 대상자들의 환경적 조건을 세밀한 조건으로 제한하거나, 설문지 등으로 다른 요인들을 조사한 연구를 수행하여야 할 것이다.
그러나 본 실험에서는 이러한 다양한 조건들을 조절하지 않았음에도 불구하고 PCR을 통한 S. mutans의 측정에서 그 측정 능력이 Dentocult®-SM strip mutans를 이용한 것보다 11% 더 높은 것으로 나타났으며 단일클론항체를 이용하여 측정한 경우, log2로 그 값을 나타냈을 때 가장 낮은 값은 0.43이었고 가장 높은 값은 3.10으로 값의 차이는 있었으나 S. mutans를 100% 검출하였다.
따라서 본 연구에서 얻어진 결과를 토대로 하여, 더 통제된 조건하에 실험이 진행된다면 보다 나은 실험 결과를 얻을 수 있을 것이라 여겨지며 차후 보강 실험을 통해 단일항체를 이용한 치아우식 예방연구와 현 제품보다 더 활용도 높은 S. mutans 측정 제품 개발을 위한 연구를 수행할 수 있을 것이다.
Ⅴ. 결 론
연구 대상인 세 군 모두에서 단일클론항체를 사용한 타액 내 S. mutans의 검출값과 연구 대상들의 DMFT, Dentocult®- SM strip mutans를 이용한 colony density (CFU/mL), 그리고 PCR을 이용한 S. mutans와 S. sobrinus 존재여부 실험을 수행한 결과, 총 97명의 피실험자 중 DMFT가 0인 대상은 8명으로 이 중 18%에서 S. mutans가 검출되었고 50%에서 S. sobrinus가 검출되었으며 32%에서는 둘 다 검출되지 않음으로서, S. sobrinus가 치아우식 형성에 큰 영향을 주지 않는 요인임이 관찰되었다. 또한 S. mutans의 단백질인 gtf B, C, D와 Ag I/II에 대한 단일클론항체들을 이용하여 S. mutans를 검출하였을 때 그 검출 능력이 Dentocult®-SM strip mutans나 PCR보다 뛰어남을 보였다. 이러한 결과들을 토대로 본 실험은, S. mutans는 치아우식 형성에 주요 원인균으로 S. mutans를 예측하는 것이 치아우식 예방을 위한 전제조건이 될 수 있으며 이를 위해 이 균에 대한 검출 능력이 뛰어난 S. mutans의 Ag I/II와 gtf B, C, D에 대한 단일클론항체를 이용할 수 있다는 것을 보여주었다. 또한 이 단일클론항체들을 이용하여 S. mutans 검출 제품에 대한 개발 연구 가능성을 제시할 수 있을 것으로 생각된다.