국내 시판 우유와 저지방 우유의 Streptococcus mutans 세균막에 대한 우식원성 비교
Comparison of Cariogenicity of Bovine Milk and Low-fat Milk on Streptococcus mutans Biofilm
Article information
Abstract
본 연구의 목적은 국내 상품화된 일반 우유와 저지방 우유의 우식원성을 CDC Biofilm Reactor를 사용한 세균막 모델을 통해 비교하는 것이다.
소의 법랑질 시편에 Streptococcus mutans ATCC 25175 세균막을 형성하였다. 하루에 3번 일반 우유, 저지방 우유와 0.9% 생리식염수를 세균막에 노출시켰다. 시간의 흐름에 따른 배지의 pH 변화를 측정하였다. 실험 5일째 시편에서 세균막을 분리하여 세균의 집락형성단위를 측정하였다. 세균막의 두께는 공초점현미경으로 관찰하였다. 실험 전, 후의 표면미세경도를 측정하여 시편의 미세경도변화율을 평가하였다. 세 군 간의 pH 변화 양상과 세균막 두께는 유사하였으며 미세경도변화율과 세균의 집락형성단위는 유의한 차이를 보이지 않았다(p> 0.05).
본 연구 결과, 일반 우유와 저지방 우유의 우식원성은 차이를 보이지 않았으며, 우유는 우식에 대해 안전한 식품임을 확인하였다.
Trans Abstract
The purpose of this study was to compare the cariogenicity of commercially available bovine milk and low-fat milk in a biofilm model using the CDC Biofilm Reactor.
Streptococcus mutans ATCC 25175 biofilms were formed on saliva coated bovine enamel slabs in a CDC Biofilm Reactor. Biofilms were exposed three times per day to one of the following materials: commercial whole milk (fat content: 3.4%), low-fat milk (fat content: 1%), or 0.9% NaCl. Medium pH was measured at different time points. After 5 days, biofilms were separated from slabs to evaluate the CFUs. The biofilm thickness was observed by confocal laser-scanning microscopy (CLSM). Enamel slab’s demineralization was assessed by measuring surface microhardness before and after the experiment.
For microhardness and CFUs assessment, no significant difference was found among the three groups. All groups showed similar pattern of medium pH change and biofilm thickness.
Our results showed that there was no difference in the cariogenicity between whole milk and low-fat milk. Both milks were relatively non-cariogenic compared to the control group.
I. 서 론
치아우식증은 세계에서 가장 흔한 만성질환 중 하나이다. 구강보건 향상에 따라 지난 수십 년간 치아우식증의 유병률이 감소하였음에도 불구하고, 아직까지 대부분의 성인과 60 - 90%의 학령기 어린이들이 치아우식증에 이환되어 있다[1,2]. 우리나라 역시 치아우식증 유병률 감소를 보여왔지만, 선진국에 비해 높은 우식경험영구치지수를 보이며, 치아우식증이 중요한 공중구강보건문제임을 알 수 있다[1,2].
치아우식증은 치면에 부착하는 치면세균막에 의해 발생되며 구강 내로 유입되는 음식물과 밀접한 연관이 있다[3]. 세균막 내부의 세균은 음식물의 탄수화물을 대사하여 산성조건을 형성하며, 산성인 환경에서 산을 생성하는 Streptococcus mutans 등의 증식이 가속화되고 세균막의 산성화가 심화되어 치아의 탈회가 발생한다[4,5]. 반면 항균 혹은 항우식 성분의 유입은 세균의 대사와 생활력에 영향을 미쳐 우식의 진행을 막거나 탈회된 조직의 재광화를 유도할 수 있다[6-8]. 따라서 일상적으로 섭취하는 음식물이 세균막에 미치는 영향을 파악하는 것이 치아우식증의 예방과 조절을 위해 필요하다.
모든 연령층에서 잦은 빈도로 섭취하는 유제품은 발효성 탄수화물인 젖당을 함유하고 있으나 우식원성이 적거나 혹은 없다고 보고되고 있으며 상대적으로 우식에 안전한 식품으로 분류된다[9,10]. 이는 우유에 함유된 다른 구성 성분이 항우식 효과를 보이기 때문이다. 우유의 각 구성 성분을 분리하여 연구한 결과 락토페린, 라이소자임, 락토페록시다제 등은 항균 효과를 나타냈으며, 카세인 인산펩타이드는 치아의 탈회와 재광화에 영향을 미쳐 항우식 효과를 보였다[11].
지방 혹은 유지방은 획득피막의 소수성을 증가시켜 세균의 집락을 방해하고, 법랑질의 탈회를 감소시키며, 음식물의 잔류를 줄여 치아우식의 예방 효과를 가진다고 보고되었다[12-14]. 지방에 포함된 지방산 역시 전자전달계의 방해 효과, 산화적 인산화 방해 효과, 세포용해 효과, 효소 활성 방해 효과 그리고 양친매성 구조로 인한 계면활성제 효과 등으로 살균 혹은 정균 작용을 일으킨다고 한다[15].
최근 심혈관계 질환의 위험도를 낮추고자 혹은 체중조절을 위하여, 지방의 섭취를 줄이려는 경향이 형성되었고, 지방 함량을 줄인 유제품이 상품화되고 소비가 늘고 있다[16]. 그러나 항우식 효과를 보이는 유지방의 함량을 인위적으로 낮춘 저지방 우유에 대한 연구는 많지 않으며, 우유의 각 구성 성분을 분리하지 않고 실제 소비되는 상품화된 유제품을 직접 평가한 연구는 드물다. 국내 상품화된 지방 함량이 조절된 우유를 대상으로 한 연구 또한 없는 실정이다.
따라서 본 연구는 국내 상품화된 유제품 중 일반 우유와 지방 함량을 줄인 저지방 우유의 우식원성을 CDC Biofilm Reactor(Biosurface Technologies, Bozeman, MT, USA)에서 형성한 S. mutans 세균막을 통해 비교하고자 하였다.
Ⅱ. 연구 재료 및 방법
1. 연구 재료
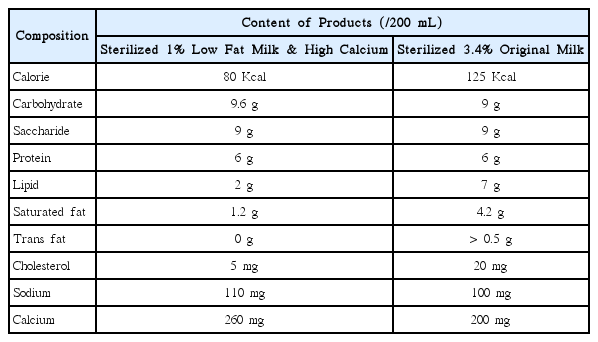
멸균우유는 특수 재질의 종이팩을 사용하여 장시간 동안 이화학적, 미생물학적으로 안정한 제품의 품질을 유지할 수 있는 특성을 가지고 있어 본 실험에서 사용하였다[17]. Ⅰ군은 대조군으로서 0.9% 생리식염수를 사용하였고, 지방 함량이 다른 멸균우유 2종 중 매일우유 저지방(1%)&고칼슘(Maeil dairies industry Co., Ltd., Seoul, Korea)은 Ⅱ군, 매일우유(Maeil dairies industry Co., Ltd., Seoul, Korea)는 Ⅲ군으로 설정하였다. 제조사에 표기된 각 제품의 성분 함량은 Table 1과 같다.
2. 타액 수집
전신질환이 없고 비흡연자인 20세 이상의 성인 3명을 대상으로 자극성 타액을 수집하였다. 연구 진행에 앞서 본 연구는 강릉원주대학교 치과 병원의 임상시험심사위원회로부터 IRB 승인(IRB 2015-013)을 받았다. 실험에 대한 설명 후 사전동의서를 받고 타액을 수집하였다. 대상자로부터 얻은 자극성 타액은 4°C에서 30분 동안 원심분리(27,000 × g)하여 상층액만을 분리하였고, 멸균을 위하여 0.45 μm, 0.22 μm 크기의 필터를 순차적으로 사용하여 진공 여과(Vacuum Filter system, Coring, NY, USA)를 시행하였다[18]. 여과된 타액은 37°C, 5% CO2 조건에서 혈액한천배지에 도말 후 24시간 배양하여 무균 여부를 확인하였다. 멸균이 확인된 타액은 실험 사용 전까지 -20°C에서 보관하였다.
3. 시편제작
건전한 소의 절치를 선별하여 연조직을 제거하고 5% 차아염소산 나트륨 용액으로 소독하였다. 소독된 소의 절치는 0.9% 생리식염수에 보관하였다. 소의 절치 순면과 표면이 평평하게 위치하여 아크릴릭 레진에 매몰하였다. 순면의 법랑질은 320, 600, 1200, 2000 그리드(grid)의 샌드페이퍼를 차례대로 적용하여 평평하고 균일한 표면을 얻었다. 미세경도기(HM 125, Mitutoyo, Kawasaki, Japan)를 사용하여 100 μm씩 떨어진 세 부위에 50 g의 힘을 5초간 적용하여 비커스 경도를 측정하고 평균치를 기록하였다. 주수 하에 다이아몬드 디스크(Accutom-50, Struers, Copenhagen, Denmark)를 사용하여 6 X 6 mm2의 법랑질 시편을 제작하였다.
각 군당 8개씩 총 24개의 시편을 제작하였다. 각 군당 6개의 시편은 우식원성의 평가를 위해 사용하였으며 초기경도가 251.63 ± 45.72 kg/mm2인 법랑질 시편만을 사용하였다. 각 군당 2개의 시편은 세균막 두께 측정을 위해 사용하였다.
4. 실험균주 및 배양조건
S. mutans ATCC 25175를 BHI (Brain Heart Infusion, Becton, Dickinson and Company, Sparks, USA) 액체배지에 접종 후 5% CO2 배양기에서 24시간 배양하였다. CDC Biofilm Reactor의 내부에 접종하기 전 세균 현탁액의 광학 농도(Optical density, OD)는 0.55(600 nm)로 일정하게 조정하였다.
5. S. mutans 세균막 형성
검증된 프로토콜을 CDC Biofilm Reactor (Fig. 1A)에 적용하여 총 5일간 S. mutans 세균막을 성장시켰다[19]. 로드(rod)를 제외한 CDC Biofilm Reactor와 우유를 보관할 용기 그리고 BHI 액체배지를 고압증기멸균법을 사용하여 121°C에서 15분 동안 멸균하였다. 제작된 시편은 CDC Biofilm Reactor의 로드 중 가장 아랫부분의 홀더에 실리콘 인상재를 사용하여 장착하였다(Fig. 1B). 시편이 장착된 로드는 시편의 미세경도에 영향을 줄 수 있는 온도 변화를 피하고자 에틸렌옥사이드 멸균법을 사용하여 멸균하였다. 멸균된 시편은 30분 동안 타액에 노출시켜 획득피막을 형성하고 CDC Biofilm Reactor에 설치하였다.

(A) CDC Biofilm Reactor, (B) CDC Biofilm Reactor sampling rods with specimens, (C) Experimental set-up for the CDC Biofilm Reactor.
각 우유는 피펫을 사용하여 용기에 담았다. 100 mL의 S. mutans 현탁액과 300 mL의 BHI 액체배지를 CDC Biofilm Reactor의 내부에 공급하였다. CDC Biofilm Reactor는 37°C 배양기 내부에 설치한 자기 교반기에 위치시켰다(Fig. 1C). 자기 교반베인(magnetic stir vane)이 와류를 형성하여 세균막에 전단응력을 가할 수 있도록 자기 교반기의 속도는 50 RPM으로 설정하였다. 초기 24시간 동안 배지의 유입 없이 와류만 형성하여 전단응력을 유지한 채 세균막의 성장을 유도하였다. 24시간 이후 정량펌프(peristaltic pump, JWSE100, JenieWell, Seoul, South Korea)를 이용하여 18.6 mL/h의 속도로 BHI 액체배지의 유입과 배출을 유도하였다[20].
일반 우유(3.4% 지방 함유)와 저지방 우유(1% 지방 함유), 0.9% 생리식염수를 포함한 실험 용액의 노출은 실험 2일째부터 5일째까지 실시하였다. 평균적인 식사 시간을 모방하기 위해 하루에 3번 오전 8:30, 오후 12:30, 오후 6:30에 시행하였다. 실험 용액의 노출을 위해 배지의 유입과 와류 형성을 중단시킨 후, CDC Biofilm Reactor를 기울여 내부의 배지를 모두 흘려보내고 각 실험 용액을 시편이 잠길 만큼 유입시켰으며 와류를 형성하며 5분 동안 적용하였다. 실험 용액을 흘려보낸 후 세척을 위한 0.9% 생리식염수를 유입시킨 다음 흘려보냈다. 대조군 역시 동일 과정을 시행하였다. 펌프를 최대속도로 설정하여 CDC Biofilm Reactor 내부에 BHI 액체배지를 채운 후, 다시 18.6 mL/h의 속도로 BHI 액체배지의 유입과 배출 및 와류 형성을 지속시켰다.
6. pH 변화 측정
CDC Biofilm Reactor 내부의 액체배지를 수집하였고, pH 미터(Microcomputer pH-vision 6071, JENCO Electronics Ltd, Taipei, Taiwan)에 pH 전극(Model 600E, JENCO Electronics Ltd, Taipei, Taiwan)을 연결하여 pH를 측정하였다. 최초 측정은 CDC Biofilm Reactor가 설치된 직후에 실시하였으며, 그 이후로는 매 실험 용액 노출 직전에 측정하였고, 마지막 측정은 CDC Biofilm Reactor에서 세균막을 분리하기 직전에 시행하였다. 측정은 3회 반복하여 평균치를 기록하였다.
7. 세균막 두께 측정
실험 종료 후 두께를 측정하기 위해 장착했던 각 군당 2개의 시편은 세균막을 분리하지 않고 공초점현미경(FV300, Olympus, Tokyo, Japan)을 사용하여 세균막의 두께를 측정하였다. 세균막은 제조사의 지시에 따라 LIVE/DEAD® BacLight™ Bacterial Viability Kit solution (Molecular Probes, Inc. Eugene, OR, USA)으로 염색하였다. 아르곤 레이저(485 ± 14 nm)를 조사하였고 방출된 형광은 두 개의 필터(500 nm SYTO 9, 635 nm propidium iodide)를 통하여 수집하였다. 얻어진 영상은 영상 처리 프로그램(FluoView 5.0, Olympus, Tokyo, Japan)을 사용하여 편집하였다. 세균막의 형광 영상이 얻어지지 않는 최상층과 최하층 부위를 설정하고, 프로그램이 설정한 가장 최적화된 두께로 각 층의 영상을 얻었다. 최상층과 최하층 사이의 두께를 산출하여 세균막의 두께를 측정하였다.
8. 세균의 집락형성단위 측정(Colony forming unit, CFU/mL)
실험 종료 후 CDC Biofilm Reactor에서 로드를 분리하였다. 시편은 phosphate buffered saline (PBS)으로 3번 세척한 후 실리콘 인상재에서 분리하여 2 mL PBS가 담긴 튜브에 위치시켰다. 시편이 담긴 튜브를 15초간 초음파 처리하여 세균막을 시편으로부터 분리하였다. PBS를 사용하여 세균 현탁액을 순차적으로 희석한 후 0.05 mL의 희석액을 시료자동분주기(Eddy Jet Spiral Plater, IUL Instruments, Barcelona, Spain)를 이용하여 혈액한천배지에 도말하였다. 37°C, 5% CO2 배양기에 24시간 배양 후 세균의 집락을 Colony counter (Flash & Go, IUL Instruments, Barcelona, Spain)로 계수하여 CFU/mL를 구하였다.
9. 미세경도의 변화 측정
미세경도의 변화 측정은 우식학에서 광범위하게 이용되고 있으며, 탈회를 평가하는 신뢰할 만한 방법이다[21]. 실험이 종료된 후 법랑질의 미세경도를 시편 제작 시 측정한 방법과 동일하게 측정하였고 미세경도변화율을 다음과 같이 계산하였다.
10. 통계 분석
각 군의 CFU/mL와 미세경도변화율의 평균과 표준편차를 산출하였다. 자료의 정규성 검사를 위해 Shapiro-Wilk test를 시행하였고 검사 결과 미세경도변화율은 정규성을 확인 후 일원배치 분산분석을 시행하였다. CFU/mL는 정규성을 따르지 않아 비모수 분석인 Kruskal-Wallis 검정을 시행하였다. 설정한 유의값은 0.05였다. 통계분석은 SPSS 22.0 (SPSS Inc., Chicago, IL, U.S.A) 통계프로그램을 사용하였다.
Ⅲ. 연구 성적
1. pH 변화
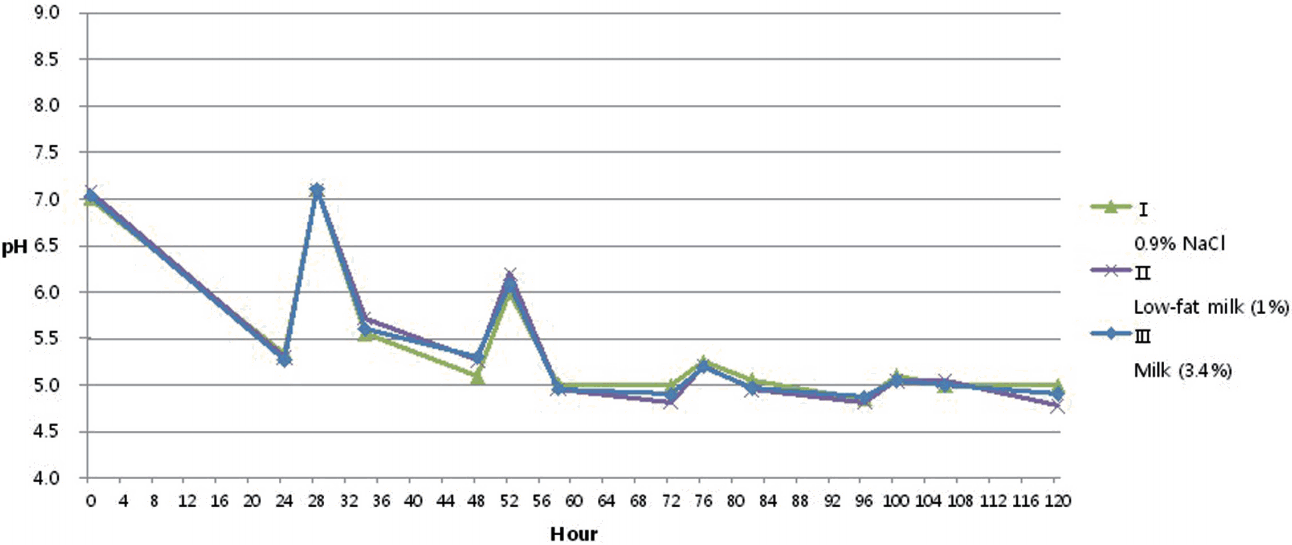
각 군에서 CDC Biofilm Reactor 내부의 배지를 수집하여 시간당 pH를 측정하였을 때, 세균막의 성장을 유도한 24시간 후의 pH를 제외하고, 모든 군에서 배지의 교체 여부와 상관없이 58시간 이후 지속적으로 탈회 임계 pH인 5.5 이하의 값을 보였으며, 실험 5일째에는 pH 5 값에서 큰 변화를 보이지 않았다. 또한, 세군의 시간에 따른 pH 변화 패턴은 거의 동일 하였다(Fig. 2).
2. 세균막 두께
0.9% 생리식염수를 노출한 Ⅰ군의 세균막 두께는 10.1 μm, 12.4 μm를 보였고 평균값은 11.3 μm이었다. 저지방 우유를 노출한 Ⅱ군의 세균막 두께는 11 μm, 12.1 μm를 보였고 평균값은 11.6 μm이었다. 일반 우유를 노출한 Ⅲ군의 세균막 두께는 13 μm, 11.6 μm를 보였고 평균값은 12.3 μm를 보였으며 세 군의 세균막 두께는 비슷한 값을 나타냈다. 각 시편에 형성된 세균막의 최상층과 최하층을 포함하는 대표적인 5장의 영상을 Fig. 3에 나타내었다.
3. 세균의 집락형성단위
각 군의 mL당 집락형성단위의 평균값은 I군은 6.45 × 106, II군은 6.94 × 106, III군은 5.80 × 106을 보였으며, Kruskal-Wallis 검정을 통해 비교한 결과 세 군의 집락형성단위는 유의한 차이가 없었다(p= 0.312)(Table 2).
Ⅳ. 총괄 및 고찰
구강의 미생물들은 부유 상태가 아닌 세균막의 형태로 치아우식증을 유발한다. 따라서 치아우식증의 미생물적 연구는 세균막에 중점을 두고 있으며, 실험실에서 세균막을 형성하기 위한 다양한 시스템의 발전이 이루어졌다. 24 well plate culture 혹은 Calgray biofilm device와 같이 정적인 조건에서 세균막을 형성하는 시스템은 타액이나 치은열구액 등의 유체의 흐름을 재현하지 못한다. 유체의 흐름과 흐름 속도 및 유체의 흐름으로부터 발생하는 전단응력의 강도는 세균막의 구조와 확산특성에 영향을 미친다고 알려져 있다[22-24]. 또한 강한 전단응력에서 생성된 세균막은 이화작용이 증가할 수 있으며, 항균 물질에 대한 반응이 정적인 조건에서 형성된 세균막과 다를 수 있다고 보고되었다[24-26]. 최근에 개발된 CDC Biofilm Reactor는 지속적인 배지를 공급하고 와류를 형성하여 세균막에 전단응력을 가할 수 있도록 제작되었다[27,28]. 따라서 본 연구는 CDC Biofilm Reactor를 사용하여 배지와 실험 용액의 유체역학적 조건에서 S. mutans 세균막을 형성하여 구강 내의 환경을 재현하고자 하였다.
국내 시판되는 우유의 종류에는 살균우유와 멸균우유가 있으며, 예비연구에서 살균우유의 오염 가능성이 높았기 때문에 멸균우유를 사용하기로 결정하였다. 우유의 지방 함량에 따른 우식원성을 평가하기 위해 대조군으로서 무지방 우유를 사용하려 했으나, 국내 시판된 멸균 무지방 우유가 없었기 때문에 0.9% 생리식염수를 대조군으로 사용하였다.
음식물의 우식원성은 지방의 함량에 따라 달라질 수 있다고 알려져 있다[29]. 우유와 유지방이 제거된 우유에 산성 용액을 첨가 시 유지방이 제거된 우유에서 법랑질의 탈회가 더 많이 발생했다고 보고되었다[12,30]. 또한 유지방에 포함된 지방산이 S. mutans 를 포함한 구강 내 병원균에 대해 항균 효과를 보였으며, 실제 유지방과 동일한 비율의 지방산을 조합한 제조액이 살균 효과를 가진다고 보고되었다[31-34]. 따라서 우유의 지방 함량 변화가 우식원성에 영향을 미칠 수 있을 것으로 생각되었지만, 본 연구의 결과 일반 우유와 저지방 우유를 노출한 군의 세균집락단위는 유의한 차이를 보이지 않았고, 우유의 지방 함량 감소로 인한 세균의 생활력은 차이가 없었다. S. mutans 세균막에 대한 다양한 우유의 영향을 평가한 이전의 연구에서도 저지방 우유와 일반 우유의 처리에 따른 세균수의 차이는 관찰되지 않았다고 보고하였다[35]. 이는 일반 우유와 저지방 우유의 지방 함량 차이가 S. mutans 세균막에 영향을 줄 수 있을 만큼 크지 않았기 때문이라 추측된다. 유지방에 포함된 대부분의 지방산은 glycerol과 합성되어 triglycerides의 형태로 존재하며, 항균 작용을 나타내는 유리지방산은 유지방의 0.1%에 불과하다[36]. 우유에 포함된 유리지방산의 실제 농도는 매우 낮으며, 지방산의 항균 효과는 농도 의존적이기 때문에 두 우유의 유리지방산 농도 차이가 S. mutans 세균막에 영향을 줄 수 있을 만큼 크지 않았을 것으로 생각된다[34].
두 군의 미세경도변화율 역시 유의한 차이를 보이지 않았으며 시간에 따른 pH 변화의 차이도 관찰되지 않아 S. mutans 세균막의 산생성능에도 차이가 없었음을 확인하였다. 그러나 본 연구와는 달리 Giacaman과 Munoz-Sandoval[35]은 우유의 지방 함량이 낮을수록 높은 법랑질의 미세경도하락율과 배지의 pH 하락을 보였다고 보고하였다. 정적인 well plate에서 세균막을 형성한 Giacaman과 Munoz-Sandoval[35]의 연구와는 달리 본 연구에서는 유체의 흐름 및 전단응력 하에 세균막을 형성하였다. 이러한 형성조건의 차이로 인해 S. mutans 세균막의 반응의 차이가 있었다고 생각된다.
공초점현미경으로 관찰한 세균막의 두께 역시 비슷한 값을 보였다. 세균막의 두께는 세균막의 생활력을 나타내며, 법랑질의 탈회 정도와 상관관계가 있다고 보고되었다[37,38]. 실험 디자인의 한계로 표본수가 부족하여 통계적 검증은 할 수 없었으나, 세균막 두께에 대한 본 연구의 결과는 유의한 차이가 없는 세균의 생활력 및 산생성능과 일치하는 경향을 반영하였다고 생각된다.
역학 조사 및 동물 실험을 포함한 많은 연구가 우유는 우식원성이 없거나 적다고 보고하고 있다[9,39,40]. S. mutans 세균막에 대한 불소 우유와 우유의 효과에 관한 연구에서도 우유와 0.9% 생리식염수의 우식원성에 차이가 없다고 보고하였다[7]. 본 연구에서도 우유의 적용으로 인한 S. mutans 세균막의 생활력과 산생성능이 대조군과 차이를 보이지 않아 우유가 우식에 대해 안전한 식품임을 확인할 수 있었다.
우유의 유지방은 세균막이 형성되기 전 획득피막과 법랑질 표면에 작용하여 우식의 예방에 도움을 줄 수 있다고 보고되었다[12,14]. 그러나 본 연구에서는 세균막 형성 후 우유를 노출했기 때문에 이와 같은 효과는 기대할 수 없었다. 향후의 연구에서는 현재 시판되는 멸균우유와 동일 조성의 무지방 우유를 조제하여 유지방 자체의 항우식 효과를 평가하는 것이 필요하다. 그리고 유지방이 법랑질 표면과 획득피막에 어떠한 영향을 미치는지를 평가하는 것이 필요하다.
Ⅴ. 결 론
본 연구에서는 국내 상품화된 일반 우유와 저지방 우유를 CDC Biofilm Reactor에서 형성한 S. mutans 세균막에 노출시켜 두 우유의 우식원성을 비교하였으며 그 결과 다음과 같은 결론을 얻었다.
일반 우유(3.4% 지방 함유)와 저지방 우유(1% 지방 함유)가 S. mutans의 생활력, 소의 법랑질 시편의 미세경도변화율과 세균막의 산생성능, 그리고 세균막의 두께에 미치는 영향은 차이가 없었다. 국내 상품화된 일반 우유(3.4% 지방 함유)와 저지방 우유(1% 지방 함유)의 S. mutans 세균막에 대한 우식원성은 차이가 없었다.
0.9% 생리식염수를 처리한 군과 일반 우유(3.4% 지방 함유)와 저지방 우유(1% 지방 함유)를 처리한 군의 차이가 없음을 바탕으로 우유가 우식에 대해 안전한 식품임을 확인할 수 있었다.