근관내 약제가 규산칼슘 기반 재료의 압출 강도에 미치는 영향
Effect of Intracanal Medicaments on Push-out Bond Strength of Calcium Silicate-based Materials
Article information
Abstract
이 연구의 목적은 근관 내 약제가 규산칼슘 재료의 압출 강도(Push-out bond strength)에 미치는 영향을 평가하는 것이다.
단일 근관을 가진 40개의 인간 하악 소구치들은 대조군과 수산화칼슘, 이중 항생제, 삼중 항생제를 사용한 군 중 하나로 나뉘어졌다.
근관 세척을 통해 약제를 제거 후, 1 mm 두께로 시편들을 제작하였다. 그 후 ProRoot MTA®와 Biodentine®을 근관 내에 적용하였고, 압출 강도 실험과 파절 양상 관찰을 수행하였다.
삼중 항생제와 이중 항생제 군은 대조군과 비교하여 두 종류의 규산칼슘 기반 재료의 상아질 결합력에서 유의한 영향을 미치지 않았고, 수산화칼슘을 사용한 군은 유의한 결합력의 증가를 나타내었다. 대조군과 각각의 실험군 내에서 치근 상아질에 대한 Biodentine®의 탈락 저항은 ProRoot MTA®보다 크게 나타났다.
파절 양상에 따라 응집 파절, 혼합 파절, 접착 파절의 순서로 압출 강도의 유의한 감소가 나타났고, 대조군과 비교하여 수산화칼슘을 사용한 군에서는 응집 파절이, 항생제를 사용한 군에서는 접착 파절이 우세하였다.
Trans Abstract
The purpose of this study was to evaluate the effect of the intracanal medicaments on the push-out bond strength of the calcium silicate-based materials.
Forty extracted single-root human mandibular premolars were sectioned below cementoenamel junction. Standardized root canal dimension was obtained with a parallel post drill. The specimens were randomly divided into a control group (no medicament), and experimental groups received medicaments with either CH (calcium hydroxide), DAP (double antibiotic paste; a mixture of ciprofloxacin and metronidazole), or TAP (triple antibiotic paste; a mixture of minocycline, ciprofloxacin and metronidazole). Following removal of medicaments with irrigation, roots were cut into sections with 1-mm-thickness.
Thereafter, calcium silicate-based materials are applied to the specimens : (i) ProRoot MTA® and (ii) Biodentine®. A push-out bond strength was measured and each specimen was examined to evaluate failure mode.
Intracanal medication using CH significantly increased the bond strength to the root dentin. But there are no significant differences on the bond strength of ProRoot MTA® or Biodentine® among TAP, DAP and control groups. The dislodgement resistance of Biodentine® from root dentin was significantly higher than that of ProRoot MTA® regardless of the type of intracanal medicaments.
Ⅰ. 서 론
미성숙 영구치의 괴사된 치수의 재혈관화(revascularization) 또는 재생 근관 치료(regenerative endodontic treatment)는 치수-상아 복합체의 재건을 목표로 하는 생리학적 술식이다. 이는 괴사된 미성숙 영구치의 치근단 형성술의 대안이 될 수 있으며, 조직의 광화와 지속적이고 생리적인 치근의 발육을 가능하게 하는 술식이다[1,2]. 재생 근관 치료를 위한 주요 단계는 치근 근관계의 멸균, 치수-상아 조직 성장 인자의 유도, 개방된 치수강의 견고한 밀폐이다[3,4]. 따라서 성공적인 결과를 위해서는 근관내 약제의 적절한 사용이 필수적이다.
수산화칼슘(calcium hydroxide, CH)은 생체 적합성 뿐만 아니라 근관내 주요 병원균에 대한 항균 효과로 인해 널리 사용되는 근관내 약제이다. 그러나, 수산화칼슘은 내성 감염 중에 주요한 세균인 Enterococcus faecalis 의 제거에는 효과적이지 않고, 장기간 사용 시 치근을 약화시키는 단점이 보고되고 있다[5]. 따라서 다른 약제들이 수산화칼슘의 대안으로서 제안되거나 사용되고 있다.
Hoshino 등[1]에 의하여 고안된 삼중 항생제(triple antibiotic paste, TAP)는 ciprofloxacin, metronidazole, minocycline의 세 가지 항생제로 구성되어 있다. 다수의 연구들에서 삼중 항생제의 그람 양성 및 음성 세균에 대한 항균 특성이 보고되었다[1,6]. 한 동물 실험에서는 1.25% 차아염소산 용액(NaOCl)으로 근관을 세척했을 때 근관의 10%가 무균상태였고, 반면에 2주간 삼중 항생제를 사용한 후에는 70%의 근관이 무균 상태를 보여 삼중 항생제의 효용성을 보여주었다[7]. 다른 연구에서는 7일에서 90일 사이의 다섯 가지 기간의 동물 실험에서 삼중 항생제의 양호한 생체 적합성을 보여주고 있다[8]. 하지만 이러한 장점들에도 불구하고 minocycline이 치관의 변색을 야기한다는 보고들이 있어 사용에 제한점이 있다[9].
따라서 metronidazole과 ciprofloxacin으로 구성된 이중 항생제(double antibiotic paste, DAP)는 minocycline에 의한 치관 변색의 가능성을 줄여 주기 때문에 삼중 항생제의 대체제로 사용되고 있다[10]. 최근에 삼중 항생제와 이중 항생제의 인간 치주 인대 섬유모세포에 대한 세포 독성 효과와 싸이토카인 mRNA 발현 수준에 대한 비교 조사에서 삼중 항생제와 minocycline은 이중 항생제보다 인간 치주 인대 섬유모세포에 대해 높은 세포독성을 보였고, 이는 세포 생활력을 감소시키는 결과를 나타냈다[11]. 더욱이 이중 항생제는 높은 희석률에서도 근관 내 세균에 대하여 삼중 항생제와 비교할 만큼 효과적인 것으로 밝혀졌다[12].
재생 근관 치료에 사용되고 있는 다양한 약제들은 치근 상아질의 구조와 상아질 표면의 구성 성분을 변화 시킬 수 있고, 이는 치과 재료의 상아질에 대한 결합력에 영향을 줄 수 있다[13-15]. Yassen 등[16]은 항생제와 수산화칼슘이 상아질의 화학적 구조에 영향을 미칠 수 있다고 보고하였다. 얇은 상아질 벽을 보존하기 위해 재생 근관 치료 과정 중 물리적인 조직 제거 과정이 생략되면서 근관내 약제의 완전 제거가 어려워졌고, 따라서 근관 내에 잔류하는 약제는 영구적인 수복재의 접착 및 밀폐 효율에 영향을 줄 수 있다[17,18].
따라서 이 연구는 재생 근관 치료 시 사용되는 약제인 수산화칼슘, 이중 항생제, 삼중 항생제가 규산칼슘 기반 수복재료인 ProRoot MTA®와 Biodentine®의 치근 상아질의 결합력에 어떠한 영향을 미치는지 살펴보고자 하였다. 근관내 약제에 따른 규산칼슘 기반 수복재료의 치근 상아질과의 접착 강도에는 차이가 없다는 귀무가설을 설정하였다.
Ⅱ. 연구 재료 및 방법
1. 연구 재료
이번 연구는 단일 연구자에 의해 수행되었다. 40개의 직선형 단일 근관을 가진 발거된 인간의 하악 소구치가 사용되었으며, 백악법랑경계 부위를 절단하여 치근을 사용하였다. 모든 근관은 ProTaper file (Dentsply Tulsa Dental, Tulsa, OK, USA)을 이용하여 F4 크기까지 각 단계별로 2.5% NaOCl 세정 하에 기계적 근관 형성을 시행하였다. 그 후 직경 1.3 mm 크기의 포스트 드릴 버를 이용하여 근관 내강의 크기를 표준화 하였다. 도말층 제거를 위하여 근관은 2.5% NaOCl 용액 5 mL으로 5분간 세척 후 17% EDTA 용액 5 mL으로 5분간 세척하였다. NaOCl와 EDTA의 남아있는 영향을 피하기 위해 멸균증류수 10 mL를 이용하여 세척하였다. 근관 내부는 근관 치료용 페이퍼 포인트를 이용하여 건조하였다.
각각의 치아들은 다이아몬드 휠(Diamond Cut-off Wheel MOD10; Struers ApS, Ballerup, Denmark)과 시편 절단기(RB 205 METSAW DA; R&B Inc., Daejeon, Korea)를 이용하여 치근 중앙 1/3 영역에서 1 mm 두께의 시편으로 절단하였다. 한 개의 치아당 4개씩 총 160개의 시편을 제작하여 근관 내에 사용하는 약제에 따라 무작위로 다음의 4개의 군으로 나누었다. Ⅰ군은 대조군으로서 어떠한 약제도 사용하지 않았고, Ⅱ군은 수산화칼슘을 사용한 군(CH), Ⅲ군은 이중 항생제를 사용한 군(DAP), 마지막으로 Ⅳ군은 삼중 항생제를 사용한 군(TAP)이다. 약제를 사용한 세 군은 멸균증류수를 이용하여 분말/액체비 3:1로 혼합하였다. 모든 시편들은 37℃, 100% 항온 항습 환경에서 2주 간 보관 후 다시 2.5% NaOCl 용액 5 mL와 17% EDTA 용액 5 mL로 세척 후 마지막으로 멸균 증류수를 이용하여 최종 수세하였다. 각각의 시편들을 페이퍼 포인트를 이용하여 건조 후 소독된 유리 연판 위에서 ProRoot MTA® (Dentsply Tulsa Dental, Tulsa, OK, USA)와 Biodentine® (Septodont, Saint-Maur-des-Fosses, France)을 제조사의 지시대로 혼합 후 금속 스파튤라를 이용하여 시편의 내강 내에 균일하게 충전하였다. 준비된 시편들을 두 종류의 수복 재료에 따라 각각 2개의 하위 군으로 분류하였고, 1주일간 37℃, 100% 항온 항습 조건에서 보관하였다.
2. 연구 방법
1) 압출 강도 측정 (push-out bond strength test)
압출 강도 측정은 만능 시험기(universal testing machine) (RB 301 UNITECH; R&B Inc., Daejeon, Korea)를 이용하여 측정하였다. 각각의 시편들의 수복재가 직경 1.0 mm의 스테인리스 강 원통형 플런저(plunger)의 수직 이동 경로에 일치하도록 시편들을 준비하였다(Fig. 1). 플런저는 상아질 벽과의 접촉을 피하고 수복 재료와의 접촉만 허용하기 위하여 약 0.3 mm의 여유 공간을 마련하였다. 1 mm/min의 일정한 속도로 플런저를 이동시켜 시편에 압출력을 부여하였다. 시편 내강 수복 재료의 접착 파절이 일어날 때까지 가해진 최대 하중을 newton(N) 단위로 기록하였다. 수복재료의 탈락 저항성을 나타내는 압출 강도를 접착 계면의 면적 당 하중으로 계산하여 MPa 단위로 계산하였다. 계산에 사용된 공식은 다음과 같다 :

A cylindrical stainless steel plunger of the universal testing machine on calcium silicate-based biocompatible material inside a lumen of a root section specimen.
접착 계면의 면적(mm2)은 2πr × h로 π는 약 3.14의 원주율이고, r은 파절된 내강의 반지름, h는 시편의 두께(mm)이다.
2) 파절 양상 (failure mode)
압출 강도 측정이 시행된 모든 시편들은 40배율의 실체현미경(Olympus SZX-ILLB100; Olympus Optical Co, Tokyo, Japan)을 통해 파절 양상(failure mode)을 조사하였다. 각각의 시편들은 다음의 파절 양상에 따라 다음의 3가지 범주 중 한 가지로 분류되었다. 수복재료와 치근 상아질 계면 사이에서 발생하는 접착 파절(adhesive failure), 수복재료 내부에서 발생하는 응집 파절(cohesive failure), 이 둘이 혼재되어 있는 혼합 파절(mixed failure)이다(Fig. 2).
3) 통계 분석
실험을 통해 수집된 자료들은 SPSS 23.0.0 (IBM Corporation, Armonk, NY, USA) 소프트웨어 프로그램을 이용하여 통계적 분석을 수행하였다. 근관내 약제의 종류와 수복재료의 종류에 따른 두 가지 요인이 압출 강도에 미치는 영향을 평가하기 위하여 이원 분산 분석(2-way ANOVA)을 시행하였고, Tukey’s post hoc test 로 사후 검정을 시행하였다. 파절 양상의 빈도의 상관관계를 평가하기 위해 교차 분석(Chi-square test)를 시행하였고, 파절 양상에 따른 압출 강도의 평가를 위하여 이원 분산 분석을 시행하였다. 모든 통계적 분석은 95% 신뢰 수준에서 유의성을 평가하였다.
Ⅲ. 연구 성적
1. 압출 강도 측정
근관내 약제와 수복재료에 따른 압출 강도의 평균과 표준 편차를 측정하였다(Table 1, Fig. 3). 수산화칼슘을 근관내 약제로 사용한 군이 다른 세 군에 비하여 ProRoot MTA®와 Biodentine®의 치근 상아질에 대한 결합력이 두 군 모두에서 유의성 있게 증가하였다(p < 0.05). 이중 항생제와 삼중 항생제의 근관내 사용은 대조군과 비교하여 수복 재료의 상아질에 대한 결합 강도에 유의한 영향을 미치지 않았다(p = 0.86, p = 0.83). 하지만, 이중 항생제를 사용한 군이 삼중 항생제를 사용한 군보다 결합 강도가 다소 높은 경향을 나타냈다.

Mean push-out bond strength of calcium silicate-based materials to the root dentin after the application of calcium hydroxide (CH), double antibiotic paste (DAP), or triple antibiotic paste (TAP). Two way ANOVA (analysis of variance) and Tukey’s post hoc test (* : p < 0.05).
동일한 약제군 내에서 수복 재료의 종류에 따라 Biodentine®의 치근 상아질에 대한 결합 강도가 ProRoot MTA®의 결합 강도보다 유의하게 높게 나타났다(p < 0.05).
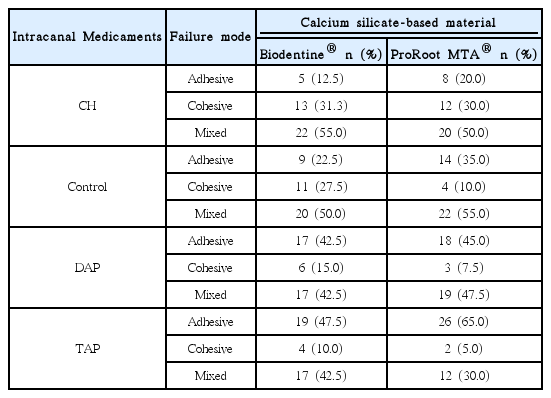
2. 파절 양상
두 가지 규산칼슘 기반 수복 재료의 종류와 파절 양상의 상관관계는 뚜렷하지 않았지만, 근관내 약제와 파절 양상별 빈도 사이의 상관관계가 나타났다. 수산화칼슘을 사용한 실험군에서 응집 파절 양상이 가장 높게 나타났고, 대조군, 이중 항생제, 삼중 항생제를 사용한 순서로 응집 파절이 나타나는 빈도수가 감소(음의 상관관계)하였다. 또한, 접착 파절의 경우 이와 반대로 삼중 항생제, 이중 항생제, 대조군, 수산화칼슘군의 순서로 빈도수가 증가(양의 상관관계)하였다(p < 0.05, Table 2, Fig. 4).

There were significant correlations among the groups according to cohesive and adhesive failure mode. Chi-square(χ2) test (* : p < 0.05).
파절 양상에 따른 압출 강도의 차이가 있는지를 알아보기 위하여 이원 분산 분석을 시행하였고, 각각의 실험군의 평균값에서 응집 파절(12.7 ± 2.9 MPa)을 나타내는 시편들의 압출 강도가 접착 파절(6.6 ± 2.5 MPa)과 혼합 파절(8.4 ± 3.3 MPa)보다 유의하게 높았다(p < 0.05).
Ⅳ. 총괄 및 고찰
재생 근관 치료는 최소한의 물리적 기구 조작을 통한 근관 내 괴사 조직의 화학적 제거가 중요 요소이다. 수산화칼슘과 여러 항생 약제가 근관 내 괴사 조직의 멸균을 위해 사용되고 있고, 근관 내 멸균 이후 MTA (mineral trioxide aggregate)와 같은 규산칼슘 기반의 최종 수복 재료가 사용되고 있다. 최종 수복재를 적용하기 전에 근관내 약제는 제거되어야 하지만 이러한 치근 근관내 약제의 완전한 제거는 매우 어렵다고 알려져 있으며, 또한 근관내 약제가 치근 상아질의 미세경도를 감소시키고 화학적 구조도 변화시킨다고 보고되었다[16,17,19,20]. 이렇듯 근관 내에 사용되는 약제는 완전한 제거가 어렵고 약제가 치근 상아질에 미치는 영향으로 인해 재생 근관 치료 시 밀폐 및 수복을 위해 사용되는 재료의 결합 강도에 영향을 줄 수 있다.
근관 치료 영역에서 널리 사용되는 규산칼슘 기반 재료인 MTA는 우수한 생체적합성, 밀폐성, 재생능력 등을 보이며 재생 근관 치료의 술식에도 널리 사용되고 있다. 위와 같은 장점에도 불구하고 MTA의 긴 경화시간, 치아 변색 등의 단점으로 인해 이를 보완한 새로운 규산칼슘 기반 재료들이 개발되어 소개되고 있으며 이 중 하나가 Biodentine®이다. 이러한 규산칼슘 기반 재료들은 천공 부위의 수복, 치수절단술, 치근단형성술, 재생 근관술식 시 근관 충전 재료의 압축, 포스트 또는 최종 수복 재료의 적용, 구강 내 기능시의 교합력과 같이 응력이 가해지는 상황에 빈번히 노출된다[21,22]. 아말감 응축 시 아말감 플러거에 의해 발생하는 압축력은 플러거의 크기에 따라 5.5±1.8 MPa에서 8.9±2.4 MPa에 이른다[23]. 이와 같은 압력들은 수복 재료의 탈락을 발생시킬 수 있기 때문에 규산칼슘 기반 재료들의 치근 상아질에 대한 결합 강도는 임상 술식에서 중요한 요소이며, 근관내 약제의 전처리가 수복 재료의 치근 상아질과의 결합력에 미치는 영향을 고려해야 할 필요성이 있다. 따라서 이 연구에서는 근관 내 약제로 사용되는 수산화칼슘, 이중 항생제, 삼중 항생제가 규산칼슘 기반 재료인 ProRoot MTA®와 Biodentine®의 치근 상아질에 대한 결합 강도에 미치는 영향을 비교 평가하고자 하였다. 결합 강도를 평가하기 위해 전단 강도, 인장 강도, 압출 강도 등을 측정하는 방법이 있는데 이 연구에서는 압출 강도를 이용한 실험을 수행하였다. 이는 압출 강도 측정이 다른 방법과 비교하여 조기 파절의 가능성이 없고 임상 조건에 근접한 모의 실험을 수행할 수 있는 효과적이고 실용적이며 신뢰성이 있는 방법으로 보고되고 있기 때문이다[24].
이 연구에서 수행한 압출 강도 실험에서 근관내 약제의 종류 및 사용 여부와 무관하게 Biodentine®의 결합 강도가 ProRoot MTA®보다 높게 나타났다. 이는 ProRoot MTA®와 Biodentine®을 다양한 근관 세정액에 노출시킨 후에 압출 강도를 실험한 Guneser 등[25]의 연구 결과와도 유사하였다. 이러한 결과는 ProRoot MTA®에 비하여 Biodentine®의 입자가 더 균일하고 작아 상아 세관으로의 침투가 용이하기 때문이며, Han과 Okiji[26]는 Biodentine®을 사용한 경우 ProRoot MTA®보다 칼슘과 규소 성분이 상아질로 더 많이 침투하는 결과를 나타낸다고 보고하였다. 이로 인해 대부분 상아 세관 내 결정 성장의 결과로 형성되는 꼬리표 유사(tag-like) 구조의 형성이 유리해지며, 이는 Biodentine®의 미세기계 결합을 더욱 강화시킨다[27].
근관내 약제의 종류에 따른 수복 재료의 압출 강도는 수산화칼슘을 사용한 군이 다른 세 군에 비하여 ProRoot MTA®와 Biodentine® 두 가지 재료에서 모두 통계적으로 유의한 결합 강도의 증가를 나타냈다. 이는 수산화칼슘 첩약이 근관내 수복 재료의 결합 강도와 미세누출에 미치는 영향에 대한 연구 결과들과 일치하였다[28,29]. 규산칼슘 기반 재료들의 경화 기전은 입자들의 수화 과정을 포함하고 인산 이온과 반응하여 수산화인회석(hydroxyapatite)층을 생성한다. 수산화인회석 결정은 규산칼슘 기반 재료들과 상아질 사이의 미세 공간을 채우고, 수산화인회석 결정의 합성과 성장은 가용한 이온들의 농도에 의존하며 잔존하는 수산화칼슘으로부터 유리되는 칼슘 이온은 인산 이온과 반응하여 수산화인회석을 합성하기 위한 가능성을 증가시킨다. 이는 중간층에서 생성되는 꼬리 양상(tag-like)의 구조를 통해 상아 세관으로 침투하고, 교원 섬유를 따라 침착하여 미세기계적 유지력을 향상시켜 결합 강도를 증가시키는 원인이 될 수 있다[30]. Porkaew[31]의 연구에서는 수산화칼슘이 탄산칼슘으로 전환되면서 규산칼슘 기반 재료의 변연 누출을 감소시킨다고 결론지었고, 이는 수산화칼슘을 약제로 사용한 군의 압출 강도의 증가를 지지하는 또 다른 가설이 될 수 있다. 하지만 다른 연구들에서는 수산화칼슘이 치근 상아질의 변성과 탈회를 야기하고, 염기성 pH로 인해 교원 섬유(collagen)와 같은 유기 단백질을 변성시켜 상아질의 기계적 특성에 부정적 영향을 미친다고 보고하고 있다[28].
이중 항생제 또는 삼중 항생제의 근관내 사용이 ProRoot MTA®와 Biodentine® 두 가지 재료에서 대조군과 비교하여 다소 낮은 압출 강도 결과를 보였지만 유의하지는 않았다. 다양한 제거 방법을 통한 근관내 약제의 잔류 정도를 연구한 Berkhoff 등[17]에 따르면 수산화칼슘은 근관 내에서 최대 95%까지 제거가 되는 반면, 삼중 항생제는 85% 이상이 치근 상아질 내에 잔류하는 것으로 나타났다. 이는 항생제가 근관 벽에 침투하여 상아질과 결합하고, 특히 삼중 항생제의 미노사이클린이 칼슘 이온과 결합하여 킬레이션(chelation)을 통한 불용성 복합체를 형성하는 것에 기인한다고 설명하고 있다[12]. Elnaghy[32]는 산성 환경일수록 ProRoot MTA®와 Biodentine®의 물리적 및 화학적 특성이 변화하고, 수산화인회석 결정의 성장과 발달이 저해된다고 하였다. 이중 항생제와 삼중 항생제는 각각 pH 3.4, pH 2.8의 값을 가지며 근관 내를 산성 환경으로 만들어 규산칼슘 기반 재료들의 상아 세관 내 결합에 영향을 줄 수 있다. 따라서 삼중 항생제 그룹이 이중 항생제 그룹에 비하여 접착 강도가 낮게 나타나는 것은 삼중 항생제의 산도가 더 높기 때문으로 생각해 볼 수 있다.
파절 양상에 따른 압출 강도의 분석에서 응집 파절이 일어난 그룹에서 결합 강도가 가장 높게 나타났고, 혼합 파절, 접착 파절의 순으로 압출 강도가 감소하였다. 파절 양상의 분포는 사용한 약제와 상관관계를 나타냈는데, 약제의 전처리에 따른 압출 강도의 평균값이 높을수록 응집 파절의 빈도수와 양의 상관관계를 보였고, 접착 파절 양상과는 음의 상관관계를 보였다. 따라서 수산화칼슘을 사용한 군에서는 수복 재료 내의 파절인 응집 파절의 비율이 가장 높았고, 그로 인해 압출 강도의 평균값이 높게 나온 것으로 보인다. 항생제를 약제로 사용한 군에서는 상아질과 수복 재료 계면 사이의 파절인 접착 파절이 우세하였고 이는 이전의 연구 결과들과 일치하였다[24,25,28]. 또한 Biodentine®을 사용한 군은 ProRoot MTA®을 사용한 군보다 응집 파절의 비율이 높고, 접착 파절의 비율이 낮았는데 이는 두 재료에서 상아질에 대한 결합 강도가 Biodentine®에서 높은 것을 반영하는 결과이다.
이 연구에서는 재생 근관 치료 시 사용되는 약제인 수산화칼슘, 이중 항생제, 삼중 항생제의 전처리에 따른 ProRoot MTA®와 Biodentine®의 치근 상아질에 대한 압출 강도를 평가하고 파절 양상에 따른 결합 강도를 비교하였다. 하지만, 실험실 환경에서 이루어진 결과라는 점과, 두 종류의 규산칼슘 기반 재료에 국한되어 있다는 것은 이 연구의 한계점으로 볼 수 있다. 따라서 추후 연구에서는 근관내 약제와 다양한 생체 활성 재료 및 수복 재료들을 사용한 임상 술식에서의 장기적인 경과 관찰이 필요할 것이다.
Ⅴ. 결 론
이 연구에서 수산화칼슘, 이중 항생제, 삼중 항생제를 근관 내 약제로 사용 후 ProRoot MTA®와 Biodentine®의 치근 상아질에 대한 결합 강도를 평가하기 위하여 압출 강도 시험을 수행하였다. 수산화칼슘을 근관내 약제로 사용하였을 때 유의하게 압출 강도가 증가하였고(p < 0.05) 이중 항생제와 삼중 항생제를 사용하였을 경우 대조군과의 유의한 차이를 보이지 않았다(p > 0.05). Biodentine®의 치근 상아질에 대한 결합 강도는 사용한 약제와 관계없이 ProRoot MTA®의 결합 강도보다 높게 나타났다(p < 0.05).
또한 파절 양상 별로 압출 강도를 측정한 결과 응집 파절, 혼합 파절, 접착 파절의 순서로 압출 강도가 감소하였고, 수산화칼슘, 이중 항생제, 삼중 항생제를 사용한 순서로 응집 파절 양상이 감소하고, 접착 파절 양상은 증가하였다.
이 연구의 결과로 볼 때, 근관내 괴사 조직의 제거 및 치수재생을 위한 다양한 근관내 약제 및 규산칼슘 기반 재료의 사용은 치근 상아질과 적절한 결합강도를 보임으로써 성공적인 재생 근관 치료의 기반이 될 수 있을 것으로 사료된다.