탈락 유치 내 치수 세포의 보관 용액과 기간에 따른 생존
Effect of Storage Media and Duration on Pulpal Cell Viability in Exfoliated Deciduous Teeth
Article information
Abstract
가정에서 유치가 탈락하였을 경우 쉽게 구할 수 있는 저장 용액에 보관한 후, 보관되었던 유치에서 세포를 배양할 수 있다면 지금보다 더 많은 유치로부터 줄기 세포를 추출할 수 있을 것이다. 본 연구는 유치의 치수 세포가 다양한 보관 용액의 종류와 기간에 영향을 받는지 확인해 보고자 하였다.
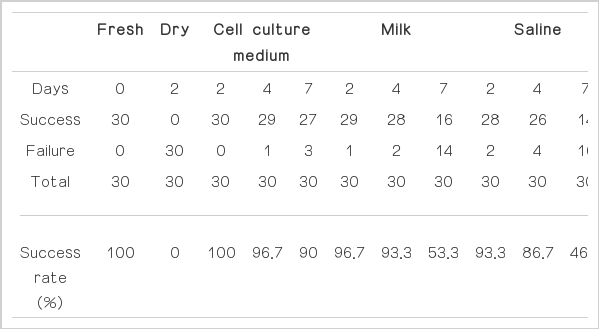
330개의 탈락 유치를 신선군, 건조군, 세포배양액 2, 4, 7일 보관군, 우유 2, 4, 7일 보관군, 생리식염수 2, 4, 7일 보관군으로 각각 30개씩 무작위로 나누었다. 각 군 간의 유치 치수 조직 세포의 일차 배양을 시행하여 성공한 개수와 실패한 개수를 계산하여 생존 성공률을 비교하였다.
일차 배양 결과 보관 기간이 늘어날수록 일차 배양 시 세포의 생존 성공률이 낮아지는 것으로 나타났다. 2일 보관군과 4일 보관군까지 세포배양액, 우유, 생리식염수 간의 보관 용액에 따른 성공률의 유의할 만한 차이는 없었다. 그러나 7일 보관군에서는 세포배양액에 비해 우유와 생리식염수에 보관한 유치에서 성공률이 유의하게 떨어지는 것으로 나타났다.
유치 발거 후 우유나 생리식염수 등의 보관용액에 일정 기간 보관 후 그 치수 조직을 세포 배양에 사용하는 것이 가능하지만 보관 기간이 길어질수록 세포 획득 가능성이 줄어든다.
Trans Abstract
If it is possible to preserve and culture cells from exfoliated deciduous teeth in a readily available storage medium within each family, more stem cells would be obtained. This research is about the effect of storage media and time on pulpal cell viability of exfoliated deciduous teeth.
330 exfoliated deciduous teeth were randomly divided into 11 groups; fresh group, dry group, groups stored in cell culture medium (2, 4, 7 days each), in milk (2, 4, 7 days each), and in saline (2, 4, 7 days each). Primary culture of pulpal cells was conducted in each group and the success rates were compared by calculating the number of teeth with viable cells.
The result of primary culture shows that the success rate decreases as the time of storage gets longer. There was no statistical difference between groups stored in the cell culture medium, milk, and saline for 2 and 4 days. However, the groups stored in milk and saline for 7 days showed dramatic decrease in success rate compared to the group stored in the cell culture medium.
In conclusion, exfoliated or extracted deciduous teeth can be used to culture pulpal cells when they are stored in milk and saline for a certain period of time; however obtaining viable pulpal cells becomes harder as the storage time gets longer.
Ⅰ. 서 론
흡수 탈락된 유치의 치수조직1), 발거된 선천치의 치수2) 및 유치의 치주인대3)에서 줄기세포를 얻을 수 있다고 보고되었다. 탈락된 유치에서 얻은 줄기세포는 비침습적으로 얻을 수 있으며, 영구치의 치수에서 얻은 줄기 세포와 비교하였을 때 더 높은 증식률, 분화능을 보였다는 보고4)가 있었다. 이러한 유치의 장점때문에 최근 유치에서 얻은 조직을 간엽성 줄기 세포의 원천으로 사용하는 연구가 활발하게 이루어지고 있다1,5-7).
치아를 용액에 보관하는 것에 대한 연구는 영구치의 이식이나 재식을 위한 치아 주변 인대 세포의 생존8-12)과 관련된 연구가 선행되었으며, 유치의 경우에는 재식이나 이식하는 경우가 없어 현재까지 탈락 유치의 보관 용액 및 조건에 따른 추출 세포의 생존률이나 특성에 대한 보고는 없는 상태이다. 그러나 유치 줄기 세포에 대한 관심이 증가하면서 치과 및 집에서 발거된 유치 추출 세포의 생존률을 높이는 방법에 대한 연구가 필요하다고 판단되고, 가정에서 불시에 유치가 탈락하였을 경우 주변에서 쉽게 구할 수 있는 저장 용액에 유치를 임시로 보관한 후 줄기세포를 추출할 수 있다면 지금보다 더 많은 유치를 줄기 세포 연구에 이용할 수 있을 것이라고 예상된다.
본 연구에서는 탈락 후 다양한 보관 매체 내에서 일정 기간동안 보관 용액에 보관한 유치의 치수에서 세포를 배양하여, 유치 치수의 세포가 보관 용액의 종류와 기간에 영향을 받는지에 대하여 연구하였다.
Ⅱ. 연구 재료 및 방법
1. 유치의 획득 및 보관
이번 연구는 2012년 1월부터 2012년 12월까지 연세대학교 치과대학 기관윤리위원회로부터 승인(2-2011-0060)과 환아 및 보호자의 동의를 받고서 이루어졌으며 만 4세에서 14세 이하의 건강한 남자 어린이 171명과 여자 어린이 159명(총 330명)으로부터 한 환아 당 한 개의 유치를 얻어, 총 330개의 유치를 실험에 이용하였다.
실험은 연세대학교 치과대학병원 소아치과에 내원한 환자의 진료 중에 얻게 된 유치 중에서 자연탈락이 가까운 치근 1/3 이하 잔존한 유전치와 유구치, 공간 관리 교정의 목적으로 발거한 유치를 대상으로 하였고 심한 치아 우식증으로 인한 치수감염의 가능성이 있는 치아, 치주염이 있는 치아, 치근의 비정상적인 치근흡수나 내흡수가 존재하는 치아, 세포 대사에 영향을 줄 수 있는 특이한 전신질환이 있는 어린이에게서 발거한 유치는 제외시켰다.
유치를 발거한 후 11개 군에 각각 30개씩 무작위로 배정하였는데, 양성 대조군으로 발치 직후 실험한 신선군, 음성 대조군으로 2일간 상온에서 건조시킨 후 실험한 건조군, 생리식염수(중외제약, 서울, 대한민국), 우유(연세우유, 아산, 대한민국), 세포배양액에 각각 2일, 4일, 7일동안 4℃에서 보관한 후 실험한 실험군(세포배양액, 우유, 생리식염수 각각 2, 4, 7일군)으로 구분하였다.
세포배양액은 minimum essential medium (- MEM; Invitrogen, Carlsbad, CA, USA)에 10% fetal bovine serum (FBS; Invitrogen), 200 U/ml penicillin (Invitrogen), 300 μg/ml streptomycin (Invitrogen), 2 mM L-glutamine (Invitrogen), 10 mM L-ascorbic acid (Sigma, St. Louis, MO, USA), 2.5 μg/ml amphotericin B (Bristol-Myers Squibb, New York, USA)가 첨가된 용액을 사용하였다. 세포배양액, 생리식염수, 우유는 3 ml씩 15 ml conical tube (SPL Life Sciences, Pocheon, Gyeonggi, Korea)에 보관하였으며, 2일마다 보관 용액을 교체해주었다.
2. 유치 치수 조직의 분리 및 일차 배양(Primary culture)
세포의 1차 배양은 outgrowth method를 사용하였다. 발거된 유치의 치수 조직은 barbed broach (Mani, Inc, Utsunomiya Toshi-ken, Japan)를 이용하여서 치수 조직 전체를 분리해냈다(Fig. 1A, 1B). 이렇게 얻어진 치수 조직은 1mm³내외의 크기로 잘게 자른 후 60 mm culture dishes (BD Falcon, Lincoln Park, NJ, USA)위에 올려 놓고(Fig. 1C) cover glass (Superior, Lauda-Königshofen, Germany)를 덮은 후 세포배양액을 첨가하였다(Fig. 1D).

Primary culture from deciduous teeth. (A) Deciduous tooth from a 10-year-old boy. (B) Pulpal tissue was taken out with barbed broach. (C) Pulpal tissue was cut off to several fragments at size of 1 mm3 and placed on a 60 mm culture dish (D) Pulpal tissue was covered with cover glass and incubated with culture medium at 37℃ in a humid atmosphere containing 5% CO2.
상기 배양 배지를 37℃의 온도, 5% CO2의 습윤환경에서 배양하여 일주일이 지난 후 관찰하였을 때 치수 조직으로부터 자라서 나오는 세포가 관찰되면 배양 성공으로 간주하였다. 관찰시에는 광학현미경(Leica microsystem, Wetzlar, Germany)을 100배율로 사용하였다.
유치 치수 조직의 일차 배양 성공 시에는 일주일 내에 전형적인 방추형의 섬유모세포 형태의 세포가 자라나오는 것이 관찰되었으며(Fig. 2A), 배양 실패 시에는 일주일이 지난 후에도 치수 조직으로부터 자라서 나오는 세포가 관찰되지 않았다(Fig. 2B).
3. 통계 분석(Statistical analysis)
결과 분석은 SPSS (19.0, IBM, Chicago, IL, USA) 프로그램을 사용하였고 치수 세포 일차 배양 성공률은 fisher’s exact test (* : p< 0.05)를 시행하였다.
Ⅲ. 결 과
1. 일차 배양(Primary culture)
신선군, 실험군(세포배양액, 우유, 생리식염수 각각 2, 4, 7일군)에서 일차 배양 성공 시 치수 조직으로부터 자라 나온 세포는 방추형이거나 섬유모세포와 유사한 형태를 보였으며, 각각의 군 사이에 차이가 없었다.
양성 대조군인 신선군은 30개 모두 일차 배양에 성공하였고, 음성 대조군인 건조군은 모두 일차 배양에 실패했다. 세포배양액, 우유, 생리식염수 실험군 중 2일 보관군은 모두 90% 이상의 일차 배양 성공률을 보였고, 4일 보관군도 세포배양액과 우유에서 90%, 생리식염수에서 86.7%의 높은 성공률을 보였다. 7일 보관군은 우유와 생리식염수에서 급격한 성공률의 감소가 관찰되었고(Table 1), 세포배양액과 비교 시 통계적으로 유의한 차이를 나타냈다(Fig. 3).
The success rate of primary culture from deciduous pulp tissues from fresh teeth, dried teeth and teeth conserved in cell culture medium, milk and saline for 2, 4 and 7days, respectively
Ⅳ. 총괄 및 고찰
줄기세포란 분화되지 않은 단일세포로서 자가재생 능력, 성숙된 전구세포 생산 능력 및 최종 목적세포로의 분화 능력을 가진 세포이다. 간엽성 줄기세포는 골수 조직, 지방조직, 근육조직, 혈액조직, 피부조직 및 치아조직 등13)에서 추출 가능하며, 최소한 세 가지 특징을 가지는데, 첫 번째는 배양판 바닥에 붙어서 배양되며, 두 번째는 CD105, CD73, CD90과 같은 세포표면표시자를 발현하고, 세 번째는 특정 분화조건에서 골모세포, 지방세포, 연골모세포로 분화가 가능한 점이다14).
치아의 치수 조직에서 배양된 세포는 자가 재생 능력, 다양한 조직으로의 분화 능력 및 자가 복제 능력을 가져 골수유래 간엽성 줄기세포와 유사한 특성을 가진다15). 본 연구와 같은 방법인 outgrowth method 로 치수 조직을 배양하여 얻은 세포에서 배아줄기세포의 표지자인 Oct-4와 Nanog, 외배엽성 중간엽 줄기세포 표지자인 Nestin, 혈관주위 세포나 신경다발주위 세포에서 발견되는 초기 간엽성 줄기세포 표지자인Stro-116) 및 간엽성 줄기세포 표지자로 알려진 CD14617)이 발현되었고 지방조직과 경조직으로의 분화 가능성을 확인하였다3). 본 연구에서 배양한 세포가 줄기 세포의 특징을 갖는지 추가적인 실험을 통한 평가와 확인이 반드시 필요하다.
조직으로부터 세포를 일차 배양하는 방법에는 enzyme digestion, mechanical disaggregation, 그리고 outgrowth method (explants culture법) 등18) 이 있다. Outgrowth method는 조직을 잘게 자른 다음 배양접시에 고정시킨 후 세포가 자라나오도록 하는 방법으로 세포가 자라 나오기까지 시간은 많이 걸리나 균일한 세포군을 얻을 수 있고 조직이 작은 경우에 유리하며 비용을 줄일 수 있는 점이 장점이 있다19). 이전까지 대부분의 유치 세포의 배양은 enzyme digestion을 이용하였으며1,20-22), outgrowth method23)를 이용한 연구는 일부 보고되었다. 치근 흡수가 진행되어 자연탈락 시기의 유치 치수에서 얻을 수 있는 조직의 양이 적어 본 연구에서는 outgrowth method가 유리할 것으로 판단되었다3).
지금까지 발거된 유치를 저장용액에 보관하는 것에 대한 연구는 거의 없었기 때문에 영구치의 이식이나 재식을 위한 재식치아 주변 인대 세포 및 치주인대세포에서 얻은 섬유모세포의 생존과 관련된 연구를 살펴보면, 세포의 생존에 영향을 미치는 요인으로는 온도, 필수 영양소 함유, 세균과 독소의 유무, 건조상태, 삼투압, pH 등9,24)이 있다.
본 연구에서 발거된 유치는 4℃의 저장 용액에 보관했는데 이유는 비교적 장기간의 보관이 필요한 실험의 목적 상 보관 온도가 낮을수록 보관 용액이 부패하거나 세균이 번식할 가능성이 적으며 세포의 부종이 감소하고 세포의 생존력이 상승되기 때문이다25). Souza 등10)의 연구에 따르면 치주인대조직을 배양하여 얻은 세포를 5℃와 20℃ 우유에서 보관한 결과, 120시간부터 5℃에 보관한 치주인대세포의 생존율이 유의하게 더 높게 나타났다고 보고하였다.
본 실험에서 세포배양액, 우유, 생리식염수가 보관용액으로 사용되었다. 세포배양액에는 세포의 생존에 필요한 영양소, 항생제 및 항진균제가 포함되어 유리한 환경을 제공하며, 우유는 Ca2+, Mg2+, glucose, platelet derived growth factor (PDGF) 등을 포함하고 있어서 세포보호 효과를 갖는다12). 각 보관 용액에 대한 이전의 연구 결과를 살펴보면 Huang 등11) 은 치주인대조직을 배양하여 얻은 세포에서 생리식염수는 3시간, 우유는 72시간까지 생존력 유지가 가능하다고 보고했다. Souza 등8)에 따르면 치주인대조직을 배양하여 얻은 섬유모세포를 sterile Hank’s balanced salt solution (sHBSS), nonsterile HBSS (nHBSS), skimmed milk, Save-A-Tooth, Minimum Essential Medium (MEM)에 보관한 후 생존을 관찰한 연구에서 37℃에서 24시간, 20℃에서 48시간까지 skimmed milk가 가장 좋은 결과를 나타냈고, 37℃에서 48시간 이후부터 MEM에서 보관한 세포의 생존률이 가장 높았다. 따라서 치주인대조직을 배양하여 얻은 세포를 장기간 보관한 실험에서는 MEM > 우유 > 생리식염수의 결과를 보이고 있음을 알 수 있다. 치주인대조직을 배양하여 얻은 세포를 대상으로 한 연구방법에 차이가 있지만 본 실험에서도 MEM > 우유 > 생리식염수의 유사한 결과를 나타냈다.
세포 생존력을 유지할 수 있는 기간에 대해서는 3시간26), 6시간27), 24시간28), 48시간8), 72시간11) 등 여러 가지 실험 결과들이 보고되었다. Souza 등10)은 우유와 MEM 용액(양성대조군)에 24시간, 48시간, 72시간, 96시간, 120시간 보관 시 치주인대조직을 배양하여 얻은 세포의 생존을 비교하였는데, 48시간부터 양성대조군의 생존율이 유의하게 높게 나타났고, 96시간까지 생존율의 큰 변화가 없다가, 120시간이 되자 우유 실험군의 생존율이 절반으로 떨어지는 결과가 관찰되었다. 치주인대조직을 배양하여 얻은 세포를 대상으로 한 연구방법과는 차이가 있지만 본 실험에서도 유사한 결과를 보였는데 4℃의 세포배양액, 우유 및 생리식염수에서 2일, 4일간 보관한 실험군 간의 세포 배양 성공률에 유의한 차이가 없었고, 7일군에서 절반 정도의 성공률을 나타냈다. 본 실험에서 4일과 7일 사이의 세포의 생존률이 급격히 떨어지는 지점에 대한 연구가 필요하다고 생각된다.
유치를 보관 용액에서 장기간 보관하는 과정과 배양하는 과정에서 미생물에 의한 오염 가능성이 있으며, 이에 의한 영향을 최소화하기 위하여 2일마다 우유와 식염수를 교체하여 주었고, 세포 배양액 내 streptomycin 농도를 300 μg/ml로 조절하였고, 항진균제인 amphotericin B를 2.5 μg/ml 추가하였다.
본 연구는 치수 조직 세포의 활성도를 관찰하거나 배양된 세포의 수나 양을 정량화하지 못하였고, 단지 세포의 생존 여부만을 관찰하였다는 한계점이 있지만, 가정에서 불시에 발거된 유치를 주변에서 쉽게 구할 수 있는 우유나 생리식염수 등의 저장용액에 임시로 보관한 후 줄기세포의 공급원으로 사용할 수 있는 가능성을 제시하여 지금보다 더 많은 유치를 줄기 세포 연구에 이용할 수 있게 해준다는 점에서 그 의의를 찾을 수 있다.
Ⅴ. 결 론
4℃ 냉장보관 시 세포배양액, 우유 그리고 생리식염수에서 보관 시 4일까지 높은 세포 배양 성공률을 보이며 세 가지 저장용액의 종류에 따른 유의한 차이가 없다. 유치 발거 후 우유나 생리식염수 등의 보관용액에 일정 기간 보관 후 그 치수 조직을 세포 배양에 사용하는 것이 가능하지만 보관 기간이 길어질수록 세포 획득 가능성이 줄어든다.

