|
 |
| J Korean Acad Pediatr Dent > Volume 41(2); 2014 > Article |
ņ┤łļĪØ
ĻĖ░ņĀĆņäĖĒż ļ¬©ļ░ś ņ”ØĒøäĻĄ░ņØĆ ņāüņŚ╝ņāēņ▓┤ ņÜ░ņä▒ ļ░®ņŗØņ£╝ļĪ£ ņ£ĀņĀäļÉśļŖö ņ¦łĒÖśņ£╝ļĪ£ ļŗżļ░£ņä▒ Ļ░üĒÖöļéŁņä▒ ņ╣śņä▒ņóģņ¢æ, ļīĆļæÉņ”Ø ļ░Å ļæÉņĀĢĻ│© ņ£ĄĻĖ░, Ļ│©Ļ▓®Ļ│ä ĻĖ░ĒśĢ ļō▒ņØä ļ│┤ņØ┤ļŖö ņ¦łĒÖśņØ┤ļŗż. ļŗżļ░£ņä▒ Ļ░üĒÖöļéŁņä▒ ņ╣śņä▒ ņóģņ¢æ, ļæÉņĀĢĻ│© ņ£ĄĻĖ░, ņ¢æņĢłĻ▓®ļ”¼ņ”ØņØä Ļ░Ćņ¦ä ļ¦ī 11ņäĖ ĒÖśņ×ÉņØś ĒĢśņĢģĻ│╝ ņāüņĢģņŚÉņä£ ļ░£ņāØĒĢ£ ļŗżņ¢æĒĢ£ Ēü¼ĻĖ░ņØś ļéŁņóģņŚÉ ļīĆĒĢ£ ņĀüņČ£ņłĀĻ│╝ ņØ┤ņóģĻ│© ņØ┤ņŗØņłĀņØä ņŗ£Ē¢ē Ēøä ĻĄÉņĀĢņĀü Ļ▓¼ņØĖņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ļéŁņóģņŚÉ ņØśĒĢ£ ļ¦żļ│Ą ņśüĻĄ¼ņ╣śļź╝ Ļ░Ćņ¦ä ņä▒ņןņżæņØĖ ĻĖ░ņĀĆņäĖĒż ļ¬©ļ░ś ņ”ØĒøäĻĄ░ ĒÖśņ×ÉņŚÉņä£ņØś ļ│┤ņĪ┤ņĀüņØĖ ņ╣śļŻīļź╝ ĒĢśņśĆĻĖ░ņŚÉ ļ¼ĖĒŚīĻ│Āņ░░Ļ│╝ ļŹöļČłņ¢┤ ļ│┤Ļ│ĀĒĢśĻ│Āņ×É ĒĢ£ļŗż.
Abstract
The basal cell nevus syndrome is also known as the Gorlin-Goltz syndrom. It is a dominant autosomal disorder which is characterized by keratocystic odontogenic tumors in the jaw, skeletal abnormalities, and multiple basal cell nevi carcinomas. This study reports an 11-year-old boy with multiple odontogenic keratocysts in the jaw, hypertelorism, and frontal bossing. When a young patient has cystic lesions with an impacted permanent teeth, it is important to preserve the teeth. For a growing patient with impacted permanent teeth, a more conservative method is suggested, which will enable the preservation the permanent teeth in Gorlin-Goltz syndrome.
ĻĖ░ņĀĆņäĖĒż ļ¬©ļ░ś ņ”ØĒøäĻĄ░, Gorlin-Goltz syndromeņØĆ ļ░£ļ│æļźĀ 1:60,000ņØ┤ļ®░1), ļé©ļģĆ ņä▒ļ╣äņØś ņ░©ņØ┤Ļ░Ć ņŚåņØ┤ ņØ╝ļ░śņĀüņ£╝ļĪ£ ņ×äņāüņ”ØņāüņØ┤ 30ņäĖ ņØ┤ņĀäņŚÉ ļ░£ņāØĒĢ£ļŗż2). 1894ļģä ņ▓śņØīņ£╝ļĪ£ ļ│┤Ļ│ĀļÉ£ ņØ┤ļלļĪ£, 1959ļģä HowellĻ│╝ Caro3)Ļ░Ć Ēö╝ļČĆņĢö ļō▒ņØ┤ ĻĖ░ņĀĆņäĖĒż ļ¬©ļ░śĻ│╝ Ļ┤ĆļĀ© ņ׳ņØīņØä ļ░ØĒ׳Ļ│Ā, 1960ļģä GrolinĻ│╝ Goltz4)ļŖö ļŗżņłśņØś ĻĖ░ņĀĆņäĖĒż ņĢöņóģ, ņØ┤ņŚ┤ ļŖæĻ│© ĻĘĖļ”¼Ļ│Ā ņĢģĻ│©ņØś ļŗżļ░£ņä▒ ļéŁĻ│╝ Ļ░ÖņØĆ ņ×äņāü ņåīĻ▓¼ņØ┤ ĒĢ©Ļ╗ś ļéśĒāĆļé£ ĒÖśņ×É 2ļ¬ģņØä ļ░£Ēæ£ĒĢśļ®░ ņ”ØĒøäĻĄ░ņ£╝ļĪ£ ņĀ£ņŗ£ĒĢśņśĆļŗż. 1982ļģä HowellĻ│╝ Anderson5)ņØĆ ņØ┤ ņ”ØĒøäĻĄ░ņØś ĒŖ╣ņ¦Ģņ£╝ļĪ£ 5Ļ░Ćņ¦Ć ņŻ╝ņÜö ņåīĻ▓¼ņØĖ ļŗżļ░£ņä▒ ĻĖ░ņĀĆņäĖĒż ļ¬©ļ░ś, ņĢģĻ│© ļéŁ, ņØ┤ņŚ┤ ļŖæĻ│©, ņåÉ, ļ░£ļ░öļŗźņØś ņåīņÖĆ, ņØ┤ņåīņä▒ ņäØĒÜīĒÖöļź╝ ļ░£Ēæ£ĒĢśņśĆļŗż. ĒŖ╣Ē׳ ĒĢ£ĻĄŁņØĖņŚÉņä£ļŖö ļŗżļ░£ņä▒ Ļ░üĒÖöļéŁņä▒ ņ╣śņä▒ņóģņ¢æ, ņåÉ, ļ░£ļ░öļŗźņØś ņåīņÖĆ, ĻĘĖļ”¼Ļ│Ā ņ¢æņĢł Ļ▓®ļ”¼ņ”ØņØ┤ ļåÆņØĆ ņ×äņāüņĀü ĒŖ╣ņ¦Ģņ£╝ļĪ£ ļéśĒāĆļé£ļŗżĻ│Ā ĒĢ£ļŗż6).
ņ╣śĻ│╝ ņśüņŚŁņŚÉņä£ ĻĖ░ņĀĆņäĖĒżļ¬©ļ░ś ņ”ØĒøäĻĄ░ ĒÖśņ×ÉņØś ņ╣śļŻīļŖö ņĢģĻ│©ņŚÉ ļ░£ņāØĒĢ£ ļŗżļ░£ņä▒ ļéŁņóģņŚÉ ļīĆĒĢ£ ņ╣śļŻīņÖĆ ļéŁņóģņŚÉ ņØ┤ĒÖśļÉ£ ļ¦żļ│ĄļÉ£ ņ╣śņĢäņŚÉ ļīĆĒĢ£ ņ╣śļŻīĻ░Ć ņŻ╝ļÉ£ Ļ┤Ćņŗ¼ņé¼ņØ┤ļŗż. ļéŁņóģņ£╝ļĪ£ ņØĖĒĢśņŚ¼ ļ░£ņāØĒĢ£ ņĢģĻ│©ņØś Ļ▓░ņåÉļČĆļŖö ļŗżņ¢æĒĢ£ ĒśĢĒā£ņØś ņØ┤ņŗØņ×¼ļź╝ ĒåĄĒĢśņŚ¼ ņ╣śļŻīļÉĀ ņłś ņ׳ņ£╝ļ®░ ņØ┤ļĢī ņé¼ņÜ®ĒĢĀ ņłś ņ׳ļŖö ņØ┤ņŗØņ×¼ ņżæņŚÉņä£ Ļ░Ćņן ņÜ░ņäĀņĀüņ£╝ļĪ£ Ļ│ĀļĀżļÉśļŖö Ļ▓āņØĆ ņ×ÉĻ░ĆĻ│© ņØ┤ņŗØņØ┤ļéś ņ”ØĒøäĻĄ░ ĒÖśņ×ÉņØś Ļ▓ĮņÜ░ ļéśņØ┤Ļ░Ć ņ¢┤ļ”░ Ļ▓ĮņÜ░Ļ░Ć ļ¦ÄņĢäņä£ ņĀüĒĢ®ĒĢ£ ņ×ÉĻ░ĆĻ│© ņØ┤ņŗØņØś Ļ│ĄņŚ¼ļČĆļź╝ ņ░ŠĻĖ░Ļ░Ć ņ¢┤ļĀżņÜ┤ Ļ▓ĮņÜ░Ļ░Ć ļ¦Äļŗż. ņØ┤ļ¤¼ĒĢ£ Ļ▓ĮņÜ░ņŚÉļŖö ļÅÖņóģĻ│©ņØ┤ļéś ņØ┤ņóģĻ│©ņØä ņØ┤ņÜ®ĒĢ£ ņØ┤ņŗØļÅä Ļ│ĀļĀżĒĢĀ ņłś ņ׳ļŗż.
ļ│Ė ņ”ØļĪĆņŚÉņä£ļŖö ļéŁņóģ ņĀüņČ£ņłĀ ļ░Å ņØ┤ņóģĻ│© ņØ┤ņŗØņłĀĻ│╝ ĻĄÉņĀĢ ņ╣śļŻīļź╝ ĒåĄĒĢśņŚ¼ ņ¢æĒśĖĒĢ£ Ļ▓░Ļ│╝ļź╝ ņ¢╗ņ¢┤ ņØ┤ņŚÉ ļ│┤Ļ│ĀĒĢśļŖö ļ░öņØ┤ļŗż.
ļ¦ī 11ņäĖ ļé©ņĢäļĪ£ 2010ļģä 2ņøö ĒĢśņĢģ ņóīņĖĪ ņĀ£1, 2ņ£ĀĻĄ¼ņ╣ś ĒĢśļ░® ņóģņ░ĮņØä ņŻ╝ņåīļĪ£ ļ│ĖņøÉņŚÉ ļé┤ņøÉĒĢśņśĆļŗż. ĒÖśņĢäļŖö ņČ£ņāØ ņ¦üĒøä ņé╝Ļ░üļæÉ(trigonocephaly, metopic suture synostosis)ļĪ£ ņä£ņÜĖļīĆĒĢÖĻĄÉļ│æņøÉņŚÉņä£ ļæÉĻ░£ņä▒ĒśĢņłĀņØä ļ░øņĢśņ£╝ļ®░ Ļ▓ĮļÅäņØś ļćīņŗżĒÖĢņן(ventriculomegaly)ņØ┤ ņ׳ņŚłņ£╝ļéś ņłśļæÉņ”ØņŚÉ ļīĆĒĢ£ ņ╣śļŻīļź╝ ņÜöĒĢĀ ņĀĢļÅäĻ░Ć ņĢäļŗłņ¢┤ņä£ Ļ▓ĮĻ│╝ļź╝ Ļ┤Ćņ░░ ņżæņØ┤ņŚłļŗż. ĒÖśņ×ÉņØś ļ░®ņé¼ņäĀ Ļ▓Ćņé¼ Ļ▓░Ļ│╝ ņāüņĢģ ņóī,ņÜ░ņĖĪ Ļ▓¼ņ╣ś ļČĆņ£ä, ņāüņĢģ ņóīņĖĪ ņĀ£2, 3ļīĆĻĄ¼ņ╣śļČĆņ£ä, ĒĢśņĢģ ņÜ░ņĖĪ ņĀ£1, 2, 3ļīĆĻĄ¼ņ╣ś ļČĆņ£ä, ĒĢśņĢģ ņóīņĖĪ ņĀ£1, 2, 3ļīĆĻĄ¼ņ╣śļČĆņ£ä, ĒĢśņĢģ ņĀäņ╣śļČĆ ĒĢśļ░® ļČĆņ£äņŚÉ ļ¦żļ│ĄļÉ£ ĒĢśņĢģ ņóīņĖĪ Ļ▓¼ņ╣śļź╝ ĒżĒĢ©ĒĢśļŖö ļŗżņ¢æĒĢ£ Ēü¼ĻĖ░ņØś Ļ░üĒÖöļéŁņä▒ ņ╣śņä▒ņóģņ¢æņØä ļ│┤ņśĆņ£╝ļ®░ ņ×äņāüņĀüņ£╝ļĪ£ļŖö ĒĢśņĢģ ņóīņĖĪ ņĀ£1, 2 ņ£ĀĻĄ¼ņ╣ś ļČĆņ£äņØś ĒśæņĖĪĒö╝ņ¦łĻ│©ņØś ļ╣äļ░Ģ, ĒīĮņ£żņØ┤ Ļ┤Ćņ░░ļÉśņŚłņ£╝ļ®░ ņ¢æņĢł Ļ▓®ļ”¼ņ”Ø ļ░Å ņĀäļæÉņĀĢ ņ£ĄĻĖ░ļź╝ ļ│┤ņśĆļŗż(Fig. 1).
ļ¦ī 11ņäĖņŚÉ ņĀäņŗĀļ¦łņĘ© ĒĢśņŚÉ ņāüņĢģ ņóī, ņÜ░ņĖĪ Ļ▓¼ņ╣śļČĆņ£ä, ņāüņĢģ ņóīņĖĪ ņĀ£1, 2, 3ļīĆĻĄ¼ņ╣śļČĆņ£ä, ĒĢśņĢģ ņÜ░ņĖĪ ņĀ£1, 2, 3ļīĆĻĄ¼ņ╣śļČĆņ£ä, ĒĢśņĢģ ņóīņĖĪ ņĀ£2, 3ļīĆĻĄ¼ņ╣śļČĆņ£ä, ĒĢśņĢģ ņĀäņ╣śļČĆ ĒĢśļ░® ļČĆņ£äņØś Ļ░üĒÖö ļéŁņä▒ ņ╣śņä▒ ņóģņ¢æņØś ļéŁņóģ ņĀüņČ£ņłĀ ļ░Å ņāüņĢģ ņóīņĖĪ ņĀ£3ļīĆĻĄ¼ņ╣ś, ĒĢśņĢģ ņóī, ņÜ░ ņĀ£3ļīĆĻĄ¼ņ╣śņØś ļ░£ņ╣śļź╝ ņŗ£Ē¢ēĒĢśņśĆĻ│Ā, ļéŁņóģ ņĀüņČ£ņłĀ Ēøä ņØĖĻ│ĄĻ│©(Bio-Oss┬« Collagen (BOC), Geistlich Pharma AG, Wolhusen, Switzerland)ņØä ņØ┤ņŗØĒĢśņŚ¼ Ļ│© ĒśĢņä▒ņØä ļÅäļ¬©ĒĢśņśĆļŗż. ļéŁņóģņ£╝ļĪ£ ņØĖĒĢśņŚ¼ ĒĢśņĢģ ĒĢśņŚ░ ļČĆņ£äņŚÉ ļ¦żļ│ĄļÉśņŚłļŹś ĒĢśņĢģ ņóīņĖĪ Ļ▓¼ņ╣śņØś ļ│┤ņĪ┤ņĀü ņ╣śļŻīļź╝ ņ£äĒĢśņŚ¼ ņØ┤ņŗØņ×¼ ņāüņŚÉ ņ×¼ņ£äņ╣ś ĒĢśņśĆļŗż(Fig. 2). ņłĀ Ēøä ņĪ░ņ¦ü Ļ▓Ćņé¼ Ļ▓░Ļ│╝ ĒĢśņĢģ ņÜ░ņĖĪ ņĀ£2, 3ļīĆĻĄ¼ņ╣śļČĆņ£ä, ĒĢśņĢģ ņóīņĖĪ ņĀ£2, 3ļīĆĻĄ¼ņ╣ś ļČĆņ£ä, ĒĢśņĢģ ņĀäņ╣śļČĆ ĒĢśļ░® ļČĆņ£äņŚÉņä£ Hematoxyllin and eosin ņŚ╝ņāēņŚÉņä£ ļéŁņóģņØś ļé┤ļ®┤ņØĆ ņŻ╝ļ”äņ¦ä ĒśĢĒā£ļĪ£ 5~10ņĖĄ ņØ┤ĒĢśņØś ņżæņĖĄĒÄĖĒÅē ņāüĒö╝ņäĖĒżļĪ£ ļŹ«ņŚ¼ ņ׳ņŚłĻ│Ā ĒĢśņĖĄ Ļ▓░ĒĢ®ņĪ░ņ¦üņØĆ ņ¢ćĻ│Ā ļČłĻĘ£ņ╣ÖĒĢ£ ņĮ£ļØ╝Ļ▓É ļŗżļ░£ļĪ£ ņØ┤ļŻ©ņ¢┤ņĀĖ ņ׳ņ¢┤ ņĀäĒśĢņĀüņØĖ Ļ░üĒÖöļéŁņä▒ ņ╣śņä▒ņóģņ¢æņØś ņĪ░ņ¦üĒĢÖņĀü ņåīĻ▓¼ņØä ļ│┤ņŚ¼ņŻ╝ņŚłļŗż(Fig. 3).
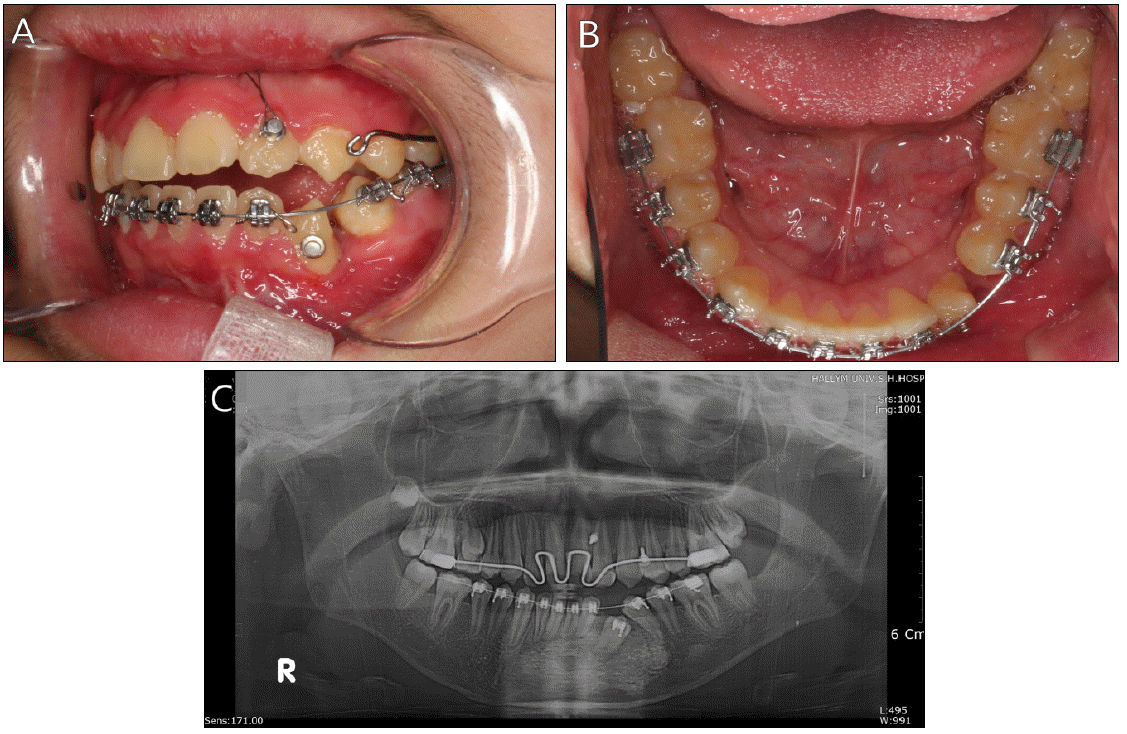
Ļ░Ćņן Ēü░ Ļ░üĒÖöļéŁņä▒ ņ╣śņä▒ņóģņ¢æņØä ļ│┤ņśĆļŹś ĒĢśņĢģ ņĀäņ╣śļČĆ ļ░Å ņóīņĖĪ Ļ▓¼ņ╣ś ņØ┤ņÖĖņØś ņłśņłĀ ļČĆņ£äļŖö Ēü░ ņØ┤ņāü ņŚåņØ┤ ņ╣śļŻīļÉśņŚłņ£╝ļéś ĒĢśņĢģ ņĀäņ╣śļČĆ ļ░Å ĒĢśņĢģ ņóīņĖĪ Ļ▓¼ņ╣ś ļČĆņ£äļŖö ņØĖĻ│Ą Ļ│© ņØ┤ņŗØņ£╝ļĪ£ ņØĖĒĢ£ Ļ│© ņäØĒÜīĒÖö ņåīĻ▓¼ņØ┤ ļéśĒāĆļé¼ļŗż(Fig. 4). ļéŁņóģ ņĀüņČ£ņłĀ Ēøä ļéŁņóģņ£╝ļĪ£ ņØĖĒĢśņŚ¼ ļ│Ćņ£ä ļ░Å ļ¦żļ│ĄļÉśņŚłļŹś ņ╣śņĢäņØś ņ×Éļ░£ņĀü ļ¦╣ņČ£ņØä ĻĖ░ļīĆĒĢśņśĆņ£╝ļéś, ņ×Éļ░£ņĀü ļ¦╣ņČ£ņØ┤ ņØ┤ļŻ©ņ¢┤ņ¦Ćņ¦Ć ņĢŖņĢä ņłśņłĀ 1ļģä Ēøä ļ»Ėļ¦╣ņČ£ ļÉ£ ĒĢśņĢģ ņóīņĖĪ ņĀ£1ņåīĻĄ¼ņ╣ś, ĻĘĖļ”¼Ļ│Ā ĒĢśņĢģ ņóīņĖĪ Ļ▓¼ņ╣śņØś ņ╣śĻ┤ĆņŚÉ ĻĄÉņĀĢ ļ▓äĒŖ╝ņØä ļČĆņ░®ĒĢśņŚ¼ ĻĄÉņĀĢņĀüņ£╝ļĪ£ ņĀĢņČ£ņŗ£ĒéżĻĖ░ ņŗ£ņ×æĒĢśņśĆļŗż(Fig. 5). ņØ┤Ēøä ĒĢśņĢģ ņ╣śņŚ┤ņŚÉ ņŚÉņ¦ĆņÖĆņØ┤ņ”ł ņןņ╣śļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ĻĄÉņĀĢņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż. ņłśņłĀ Ēøä 3ļģä 8Ļ░£ņøöņØ┤ ņ¦Ćļé£ ņ¦ĆĻĖł, Ļ░üĒÖöļéŁņä▒ ņ╣śņä▒ņóģņ¢æņØ┤ ņ׳ņŚłļŹś ņ£äņ╣śņØĖ ĒĢśņĢģ ņĀĢņżæļČĆņØś Ļ▓ĮņÜ░, ļ░®ņé¼ņäĀ ņé¼ņ¦ä ņāüņ£╝ļĪ£ ļéŁņóģ ļČĆņ£äļŖö ņ×¼ļ░£ ņåīĻ▓¼ ņŚåņØ┤ ņל ņ╣śņ£ĀļÉśĻ│Ā ņ׳ņ£╝ļ®░ ļ│Ćņ£äļÉśņŚłļŹś ĒĢśņĢģ ņóīņĖĪ ņĀ£1ņåīĻĄ¼ņ╣śņØś ņĀüņĀłĒĢ£ ļ░░ņŚ┤ņØä ņØ┤ļŻ©ņŚłņ£╝ļ®░ ņØ┤ņŗØļÉ£ ņØ┤ņóģĻ│©ņØś ņØ╝ļČĆļŖö ņŚ¼ņĀäĒ׳ ļ░®ņé¼ņäĀ ļČłĒł¼Ļ│╝ņä▒ Ļ▓░ņĀłļĪ£ Ļ┤Ćņ░░ļÉśņŚłļŗż. Ļ░üĒÖöļéŁņä▒ ņ╣śņä▒ņóģņ¢æņ£╝ļĪ£ ņØĖĒĢśņŚ¼ ĒĢśņĢģ ĒĢśņŚ░ņŚÉ ļ¦żļ│ĄļÉśņ¢┤ ņ׳ņŚłļŹś ĒĢśņĢģ ņóīņĖĪ Ļ▓¼ņ╣śņØś Ļ▓ĮņÜ░, Ļ│©ņä▒ ņ£Āņ░®ņØä ļ│┤ņŚ¼ ņÖĖĻ│╝ņĀüņ£╝ļĪ£ ņ×¼ņŗØ Ēøä Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ņżæņØ┤ļŗż(Fig. 6, 7).
ĻĖ░ņĀĆņäĖĒżļ¬©ļ░śņ”ØĒøäĻĄ░ ĒÖśņ×ÉņØś 65~100%ņŚÉņä£ ņĢģĻ│©ņØś Ļ░üĒÖöļéŁņä▒ ņ╣śņä▒ņóģņ¢æņØ┤ ļ░£ņāØĒĢ£ļŗż7,8). Ļ░üĒÖöļéŁņä▒ ņ╣śņä▒ņóģņ¢æņØĆ ņ£äņä▒ ļéŁ, Ļ░Ćņä▒ ļ░Å ņ¦äņä▒ Ļ░üĒÖö ņāüĒö╝ļĪ£ ņ×¼ļ░£ņØś Ļ░ĆļŖźņä▒ņØ┤ ļåÆļŗż9). ņØ╝ļ░śņĀüņØĖ Ļ░üĒÖöļéŁņä▒ ņ╣śņä▒ņóģņ¢æņØś ļ░£ņāØ ņŚ░ļĀ╣ņØĆ ņÜ░ļ”¼ļéśļØ╝ņŚÉņä£ ĒÅēĻĘĀ 30.8ņäĖņØ┤ņ¦Ćļ¦ī ņØ┤ ņ”ØĒøäĻĄ░ņŚÉņä£ ļ░£ņāØĒĢ£ Ļ░üĒÖöļéŁņä▒ ņ╣śņä▒ņóģņ¢æņØś Ļ▓ĮņÜ░, ļ░£ņāØ ņŚ░ļĀ╣ņØ┤ ĒÅēĻĘĀ 22ņäĖļĪ£ ļéśĒāĆļéś ņĪ░ĻĖ░ņŚÉ ļ░£ņāØĒĢ©ņØä ņĢī ņłś ņ׳ļŗż10). ļ│Ė ĒÖśņ×ÉņØś Ļ▓ĮņÜ░ 11ņäĖņŚÉ ļ░£Ļ▓¼ļÉśņ¢┤ ĒÅēĻĘĀļ│┤ļŗż ņØ┤ļźĖ ņŗ£ĻĖ░ņŚÉ ļ░£ņāØĒĢśņŚ¼ ļé┤ņøÉĒĢ£ Ļ▓āņØä ņĢī ņłś ņ׳ļŗż.
ĻĖ░ņĀĆņäĖĒżļ¬©ļ░śņ”ØĒøäĻĄ░ņØĆ ņóģņ¢æņ¢ĄņĀ£ ņ£ĀņĀäņ×ÉļĪ£ ņĢīļĀżņ¦ä ņŚ╝ņāēņ▓┤ 9q22.3ņØ┤ ņøÉņØĖ ņ£ĀņĀäņ×ÉļĪ£ ņāüņŚ╝ņāēņ▓┤ ņÜ░ņä▒ņ£╝ļĪ£ 97% gene penetranceļź╝ Ļ░¢ņ¦Ćļ¦ī ĒÖśņ×ÉņØś ņ”ØņāüņØĆ ļŗżņ¢æĒĢśĻ▓ī ļéśĒāĆļé£ļŗż11,12). ļśÉĒĢ£ Patched (PTCH)ļØ╝ ļČłļ”¼ļŖö 9q22.3ņŚ╝ņāēņ▓┤ ņāüņŚÉ ņ£äņ╣śĒĢśļŖö ņóģņ¢æņ¢ĄņĀ£ņ£ĀņĀäņ×ÉĻ░Ć ĻĖ░ņĀĆņäĖĒż ļ¬©ļ░ś ņ”ØĒøäĻĄ░ņØś ņøÉņØĖņ£╝ļĪ£ ļ░ØĒśĆņĪīĻ│Ā 1,13) ĻĘĖ ņØ┤ņÖĖņŚÉļÅä Patched 2 (PTCH2), Smmothened (SMO), Sonic hedgehog (SHH)ņ£ĀņĀäņ×ÉĻ░Ć ņøÉņØĖņ£╝ļĪ£ ļ░ØĒśĆņĀĖ ņ׳ļŗż14). ļ│Ė ĒÖśņ×ÉņØś ļČĆļ¬©ņÖĆ ļŗżļźĖ ĒśĢņĀ£ Ļ▓Ćņé¼ Ļ▓░Ļ│╝ ņĀĢņāüņ£╝ļĪ£ ĒīÉļ¬ģļÉśņŚłņ£╝ļ®░ ļ¼Ėņ¦ä Ļ▓░Ļ│╝ Ļ░ĆņĪ▒ļĀźņØĆ ņŚåņŚłļŗż.
1976ļģä Brannon15)ņØĆ Ļ░üĒÖöļéŁņä▒ ņ╣śņä▒ņóģņ¢æņØś ļåÆņØĆ ņ×¼ļ░£ļźĀņŚÉ ļīĆĒĢśņŚ¼ ņ£äņä▒ ņäĖĒżņØś ņĪ┤ņ×¼, ļéŁņóģņØś ļČłņÖäņĀäĒĢ£ ņĀüņČ£, ņŻ╝ļ│Ć ļČĆņ£äņØś Ļ░üĒÖöļéŁņä▒ ņ╣śņä▒ņóģņ¢æ ņ×¼ļ░£ņØä ņØ┤ņ£ĀļĪ£ ļōżņŚłļŗż. Ļ░üĒÖöļéŁņä▒ ņ╣śņä▒ņóģņ¢æņØś ņ╣śļŻī ļ░®ļ▓ĢņŚÉļŖö ļéŁņóģ ņĀüņČ£ņłĀ, carnoyŌĆÖs solutionĻ│╝ ĒĢ©Ļ╗ś ļéŁņóģ ņĀüņČ£ņłĀņØä ņŗ£Ē¢ēĒĢśļŖö ļ░®ļ▓Ģ, ņĪ░ļīĆņłĀ, ĻĘĖļ”¼Ļ│Ā Ļ│© ņĀłņĀ£ņłĀņØ┤ ņ׳ļŗż. Ļ░üĒÖöļéŁņä▒ ņ╣śņä▒ņóģņ¢æņØś ņ╣śļŻīļź╝ ņ£äĒĢ┤ Nakamura16)ļŖö Ļ░üĒÖöļéŁņä▒ ņ╣śņä▒ņóģņ¢æņ£╝ļĪ£ ļ¦żļ│ĄļÉ£ ņ╣śņĢäĻ░Ć ņĪ░ļīĆņłĀ Ēś╣ņØĆ Ļ░ÉņĢĢņłĀ Ēøä ņĀĢņāü ļ¦╣ņČ£ĒĢśļŖö Ļ▓ĮņÜ░ļź╝ ļ│┤Ļ│ĀĒĢśņśĆļŗż. ļśÉĒĢ£ Pogrel17)ņØĆ ņĪ░ļīĆņłĀņØä ņŗ£Ē¢ēĒĢ£ 13Ļ░£ņØś ņ”ØļĪĆ ļ│┤Ļ│Āļź╝ ĒåĄĒĢ┤ Ļ░üĒÖöļéŁņä▒ ņ╣śņä▒ņóģņ¢æņØ┤ ņ×äņāüņĀü, ļ░®ņé¼ņäĀĒĢÖņĀüņ£╝ļĪ£ ņŚåņ¢┤ņĪīņØīņØä ļ│┤Ļ│ĀĒĢśņśĆņ£╝ļ®░ ņĪ░ļīĆņłĀ ņŗ£Ē¢ēņŗ£, interleukin-1aņÖĆ ņäĖĒż ņ”ØņŗØ ļō▒ņØ┤ ņ¢ĄņĀ£ļÉśļ®┤ņä£ Ļ░üĒÖöļéŁņä▒ ņ╣śņä▒ņóģņ¢æņØś ņ╣©ņŖĄņĀüņØĖ ņä▒Ē¢źņØ┤ Ļ░ÉņåīļÉ©ņØ┤ ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŗż18). ĻĘĖļ¤¼ļéś ņĪ░ļīĆņłĀ ņŗ£Ē¢ēņŗ£ ļæÉ ļ▓łņØś ņłśņłĀņØ┤ ĒĢäņÜöĒĢĀ ņłś ņ׳ņ£╝ļ®░ ļéŁņóģ ņĪ░ņ¦üņØä ļé©Ļ▓© ļåōļŖöļŗżļŖö ļ¼ĖņĀ£ņĀÉĻ│╝ ņ×¼ļ░£ Ļ░ĆļŖźņä▒ņØ┤ ļéŁņóģ ņĀüņČ£ņłĀņŚÉ ļ╣äĒĢśņŚ¼ ļåÆļŗżļŖö ņĀÉņØ┤ ņ׳ļŗż19,20). ļéŁņóģ ņĀüņČ£ņłĀĻ│╝ carnoyŌĆÖs solutionņØä ņé¼ņÜ®ĒĢ£ Ļ▓ĮņÜ░, Ļ│© ņĀłņĀ£ņłĀĻ│╝ ļ╣äņŖĘĒĢ£ ņłśņżĆņ£╝ļĪ£ ņ×¼ļ░£ļźĀņØä ļé«ņČ£ ņłś ņ׳ņ¦Ćļ¦ī ļ│Ė ņ”ØļĪĆņÖĆ Ļ░ÖņØ┤ ĒĢśņ╣śņĪ░ ņŗĀĻ▓ĮņØ┤ ļéŁņóģ ļČĆņ£äņŚÉ ņØ┤ĒÖśļÉ£ Ļ▓ĮņÜ░, ņ¦ĆĻ░ü ļ¦łļ╣äņÖĆ Ļ░ÖņØĆ ļČĆņ×æņÜ®ņØ┤ ņ׳ņØä ņłś ņ׳ļŗż21). Ļ│© ņĀłņĀ£ņłĀņØś Ļ▓ĮņÜ░ņŚÉļŖö ņĢłļ®┤ ļ│ĆĒśĢ, ņ╣śņĢäņØś ņāüņŗż, ņØ┤ņŗØĻ│©ņØś Ļ░ÉņŚ╝, ĒĢśņ╣śņĪ░ ņŗĀĻ▓ĮņØ┤ ļéŁņóģ ļČĆņ£ä ņØ┤ĒÖśņŗ£ņØś Ļ░ÉĻ░üņåīņŗżĻ│╝ Ļ░ÖņØĆ ļČĆņ×æņÜ®ņØä ļéśĒāĆļé╝ ņłś ņ׳ļŗż19). ĻĘĖļ”¼ĒĢśņŚ¼ Ļ░Ćņן ļé«ņØĆ ņ×¼ļ░£ļźĀņØä ļéśĒāĆļé┤ļŖöļŹ░ļÅä ļČłĻĄ¼ĒĢśĻ│Ā, ņ×öņŚ¼ ņä▒ņןļ¤ēņØ┤ ļé©ņØĆ ņ▓ŁņåīļģäĻĖ░ ņØ┤ņĀäņØś ĒÖśņ×ÉņŚÉņä£ļŖö ņØ┤ņÖĆ Ļ░ÖņØĆ ļČĆņ×æņÜ®ņ£╝ļĪ£ ņØĖĒĢśņŚ¼ ņØ╝ļ░śņĀüņ£╝ļĪ£ ņé¼ņÜ®ļÉśņ¦Ć ņĢŖļŖöļŗż. ļ│Ė ĒÖśņ×ÉņŚÉņä£ļŖö Ļ░üĒÖöļéŁņä▒ ņ╣śņä▒ņóģņ¢æĻ│╝ ļ│æņåīņŚÉ ņØśĒĢ┤ ĒĢśņĢģ ĒĢśņŚ░ņ£╝ļĪ£ ļ│Ćņ£äļÉ£ ņ╣śņĢäņØś ņ╣śļŻīļź╝ ņ£äĒĢ┤ Ļ░üĒÖöļéŁņä▒ ņ╣śņä▒ņóģņ¢æņØś ņĀüņČ£ņłĀ Ēøä ļ│æņåīņŚÉ ņØ┤ĒÖśļÉ£ ņ╣śņĢäņØś ņØśļÅäņĀü ņ×¼ņ£äņ╣ś ļ░Å ļéŁņóģ ņĀüņČ£ Ēøä ļ░£ņāØĒĢ£ Ļ│© Ļ▓░ņåÉļČĆņŚÉ ļīĆĒĢ£ ņØ┤ņóģĻ│© ņØ┤ņŗØņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ļéŁņóģņØĆ ņłśņłĀ Ēøä 3ļģäņØ┤ ņ¦Ćļé£ Ēśäņ×¼ ņ×¼ļ░£ ņåīĻ▓¼ ņŚåņØ┤ Ļ│© Ļ▓░ņåÉļČĆļŖö ņל ņ╣śņ£ĀļÉśņŚłņ£╝ļ®░ ĒØĪņłśļÉśņ¦Ć ņĢŖĻ│Ā ļé©ņĢäņ׳ļŖö Ļ▓āņ£╝ļĪ£ ļ│┤ņØ┤ļŖö ņØ┤ņŗØĻ│©ņØ┤ ļ░®ņé¼ņäĀ ļČłĒł¼Ļ│╝ņä▒ Ļ▓░ņĀłļĪ£ Ļ┤Ćņ░░ļÉśņŚłļŗż. ļśÉĒĢ£ ĒĢśņĢģ ļČĆņ£äņØś ņ¦ĆĻ░ü ņØ┤ņāüņŚåņØ┤ ņĀĢņāüņĀüņØĖ ņåīĻ▓¼ņØä ļ│┤ņØ┤Ļ│Ā ņ׳ļŗż.
ņØ┤ņóģĻ│© ņØ┤ņŗØ ļČĆņ£äņØś ņ×öņŚ¼ ņä▒ņןņŚÉ ļīĆĒĢśņŚ¼ļŖö ļ│┤Ļ│ĀļÉ£ ļ░öĻ░Ć Ļ▒░ņØś ņŚåļŗż. ņāüĻĖ░ ņ”ØļĪĆņØś Ļ▓ĮņÜ░ ņØ┤ņŗØ ļČĆņ£äņŚÉ ņ×öņĪ┤ ņØ┤ņŗØņ×¼ļĪ£ ļ│┤ņØ┤ļŖö ļ░®ņé¼ņäĀ ļČłĒł¼Ļ│╝ņä▒ Ļ▓░ņĀłņØ┤ ļŗżņłś Ļ┤Ćņ░░ļÉśļŖö ļŹ░, ņØ┤ņóģ ņØ┤ņŗØņ×¼ņØś Ļ▓ĮņÜ░ ņśżļ×£ ĻĖ░Ļ░ä ĒØĪņłśļÉśņ¦Ć ņĢŖĻ│Ā ņ×öņĪ┤ĒĢ£ļŗżļŖö ļ│┤Ļ│ĀĻ░Ć ļŗżņłś ņĪ┤ņ×¼ĒĢ£ļŗż22). ĒĢśņ¦Ćļ¦ī ņØ┤ļ¤¼ĒĢ£ ņ×öņĪ┤ ņØ┤ņŗØņ×¼Ļ░Ć ĒÖśņ×ÉņØś ņä▒ņןņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņŚÉ ļīĆĒĢśņŚ¼ļŖö ņ▓┤Ļ│äņĀüņ£╝ļĪ£ ņŚ░ĻĄ¼ļÉ£ ļģ╝ļ¼ĖņØ┤ Ļ▒░ņØś ņŚåļŗż. ņä▒ņןĻĖ░ ņĢäļÅÖņŚÉņä£ ņØ┤ņóģĻ│© ņØ┤ņŗØņ×¼Ļ░Ć ņĢģņĢłļ®┤ ņśüņŚŁņŚÉ ņé¼ņÜ®ļÉ£ Ļ▓ĮņÜ░ņŚÉ ņ╣śņĪ░ņŚ┤ ĒÖśņ×ÉņŚÉņä£ Ļ▓¼ņ╣śņØś ļ¦╣ņČ£ņØä ņ£ĀļÅäĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ņé¼ņÜ®ļÉ£ ņ”ØļĪĆĻ░Ć ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŗż23). ņØ┤ļōż ņ”ØļĪĆņŚÉņä£ ņØ┤ņŗØņ×¼ļĪ£ ņØĖĒĢ£ ņä▒ņן ņןņĢĀļŖö ļ│┤Ļ│ĀļÉ£ ļ░ö ņŚåĻ│Ā ņ╣śņĢäņØś ņØ┤ļÅÖļÅä ņä▒Ļ│ĄņĀüņ£╝ļĪ£ ņØ╝ņ¢┤ļé£ Ļ▓āņ£╝ļĪ£ ļīĆļČĆļČä ļ│┤Ļ│ĀĒĢśĻ│Ā ņ׳ļŗż24). ļ│Ė ņ”ØļĪĆņŚÉņä£ļÅä ņØ┤ņŗØņ×¼ ņāüņØś ņ╣śņĢäļōżņØ┤ ĻĄÉņĀĢļĀźņŚÉ ņØśĒĢśņŚ¼ ņØ┤ļÅÖļÉ£ Ļ▓āņ£╝ļĪ£ ļ│┤ņŚ¼ ņØ┤ņŗØņ×¼ņØś ņé¼ņÜ®ņØ┤ ņä▒ņןĻĖ░ ņĢäļÅÖņŚÉņä£ ņ╣śņĢä ņØ┤ļÅÖņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØĆ ņŚåļŖö Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż. Ē¢źĒøä ĒĢśņĢģ Ļ│© ņä▒ņן ņ¢æņāüņØĆ ņČöĻ░ĆņĀüņØĖ Ļ┤Ćņ░░ņØ┤ ĒĢäņÜöĒĢśļéś ņØ┤ņŗØņ×¼ņØś ņé¼ņÜ®ņ£╝ļĪ£ ņØĖĒĢ£ Ļ│© ņä▒ņן ņןņĢĀļŖö ņŚåņØä Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż.
ĻĖ░ņĀĆņäĖĒż ļ¬©ļ░ś ņ”ØĒøäĻĄ░ņØä Ļ░Ćņ¦ä ĒÖśņ×ÉņØś ņ╣śļŻīņŚÉņä£ Ļ░üĒÖö ļéŁņä▒ ņ╣śņä▒ņóģņ¢æņØś ļéŁņóģ ņĀüņČ£ņłĀĻ│╝ ņØ┤ņóģĻ│© ņØ┤ņŗØņłĀ Ēøä ļéŁņóģņŚÉ ņØśĒĢ┤ ļ│Ćņ£äļÉ£ ņ╣śņĢäņØś ļ│┤ņĪ┤ņĀü ņ╣śļŻīļź╝ ņ£äĒĢ┤ ĻĄÉņĀĢļĀźņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņ╣śņĢäņØś ņØ┤ļÅÖņØä ņŗ£ļÅäĒĢśņŚ¼ ņĀüņĀłĒĢ£ ļ░░ņŚ┤ņØä ņØ┤ļŻ©ņŚłĻ│Ā, ĒĢśņĢģ ĒĢśņŚ░ ļČĆņ£äņŚÉ ļ¦żļ│ĄļÉśņŚłļŹś ĒĢśņĢģ ņóīņĖĪ Ļ▓¼ņ╣śņØś Ļ▓ĮņÜ░, Ļ│©ņä▒ ņ£Āņ░®ņØä ļ│┤ņŚ¼ ņÖĖĻ│╝ņĀü ņ×¼ņŗØņłĀ Ēøä Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ņżæņ£╝ļĪ£ ĒŖ╣ņØ┤ ņé¼ĒĢŁņØĆ ļ░£Ļ▓¼ļÉśņ¦Ć ņĢŖĻ│Ā ņ׳ļŗż. ņłśņłĀ ļČĆņ£ä ņŚŁņŗ£ ņłĀ Ēøä ņĢĮ 3ļģä 8Ļ░£ņøöņØ┤ ņ¦Ćļé£ ņ¦ĆĻĖł, ņ×¼ļ░£ ņåīĻ▓¼ņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖĻ│Ā ņ׳ļŗż. ņČöĒøä ļéŁņóģņØś ņ×¼ļ░£ ļ░Å ĻĖ░ņĀĆņäĖĒż ļ¬©ļ░ś ņ”ØĒøäĻĄ░ņØś ņŚ¼ļ¤¼ ņØ┤ņāü ņ”ØņāüņØä Ļ│ĀļĀżĒĢśņŚ¼ ņŻ╝ĻĖ░ņĀüņØĖ Ļ▓Ćņé¼Ļ░Ć ĒĢäņÜöĒĢśļŗż.
Fig.┬Ā1.
(A, B) Initial extraoral photograph. (C) Axial CT scan shows thinning of lingual cortical bone and thinning, expansion and perforation of buccal cortical bone of mandible. (D) Initial panoramic view. Large odontogenic keratocyst involving an impacted canine with unilocular and scalloped borders. (E) lateral cephalogram. (F) Posteroanterior cephalogram.
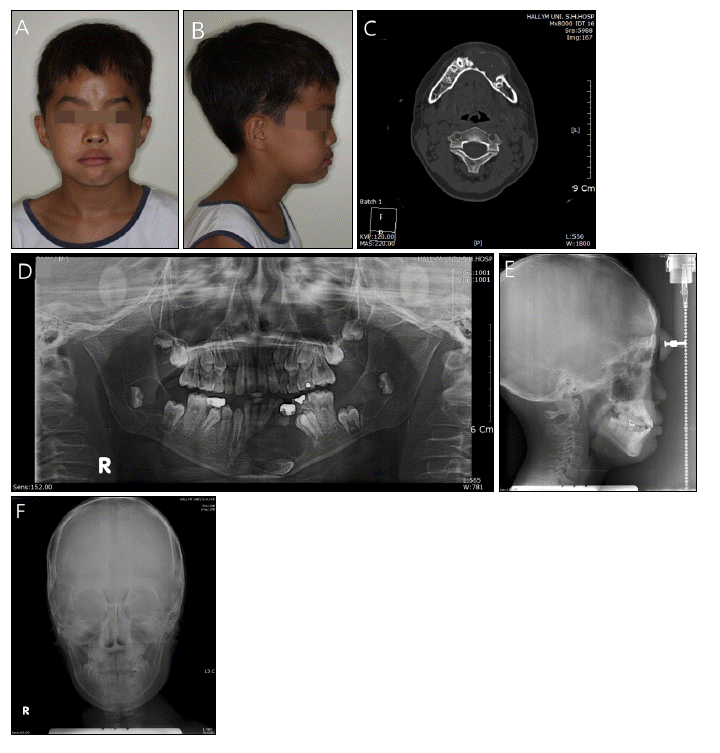
Fig.┬Ā2.
(A) Panoramic view of after cyst enucleation and xenograft. (B)(C)(D) Intraoral photograph after surgery.
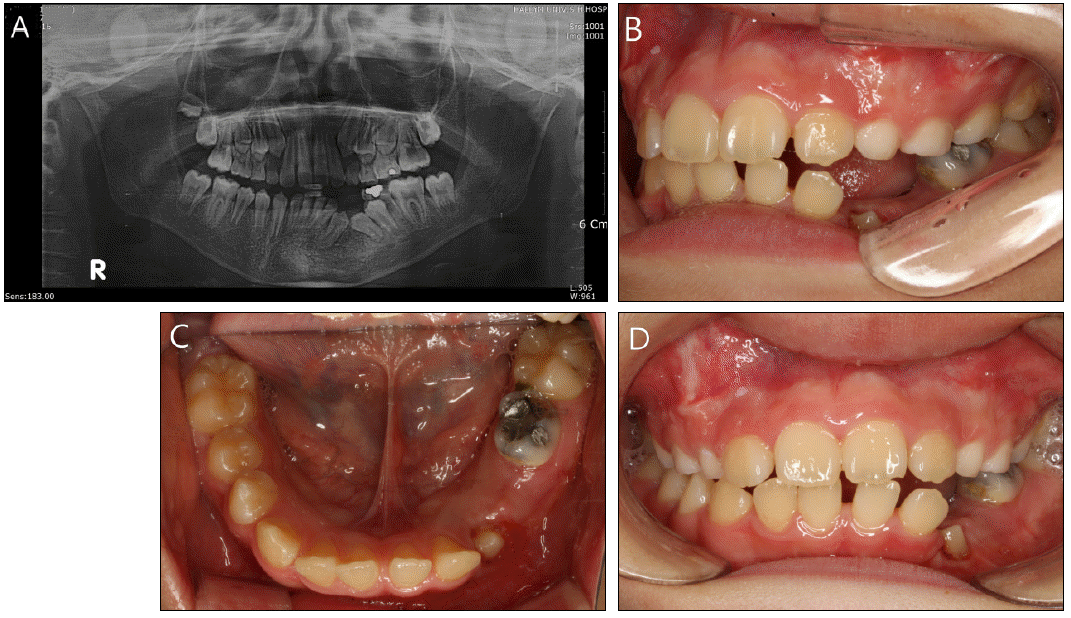
Fig.┬Ā3.
Pathological finding exhibits the histological features of a keratocystic odontogenic tumor of lower left canine area(Haematoxylin and eosin stain, original magnification: X 400).
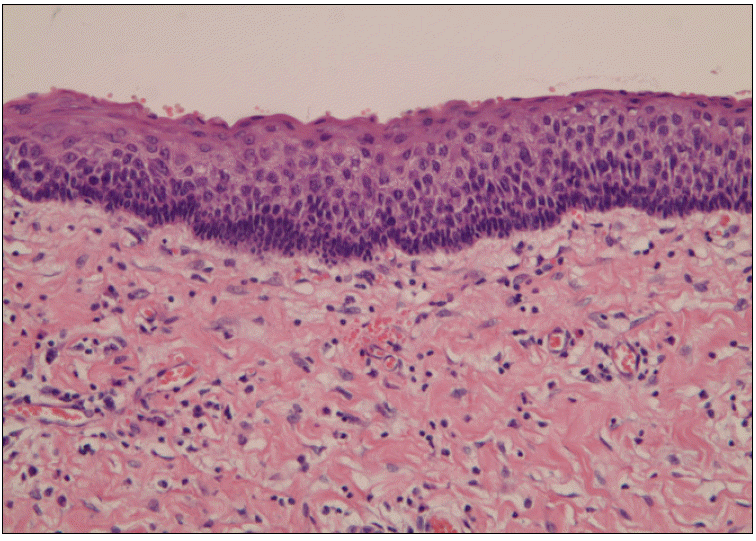
Fig.┬Ā5.
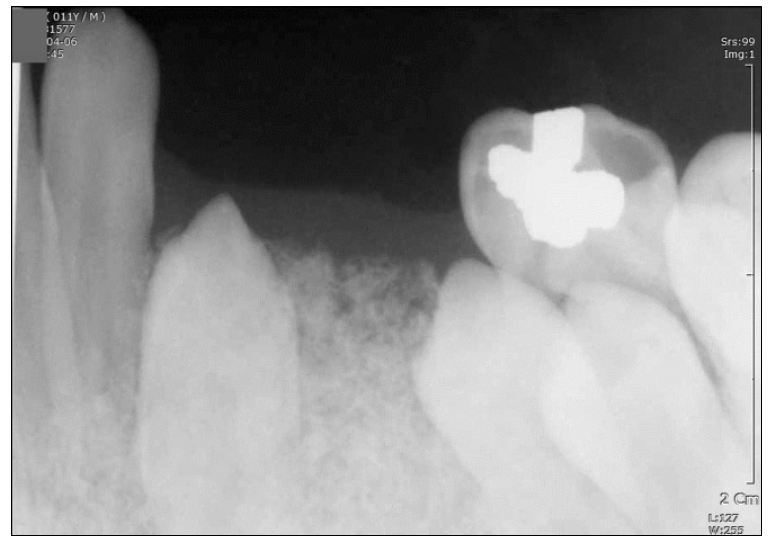
(A) Intraoral photograph of 1 year after cyst enucleation, orthodontic traction of lower left canine and first premolar. (B) Periapical view of 1 year after cyst enucleation, orthodontic traction of lower left canine and first premolar.
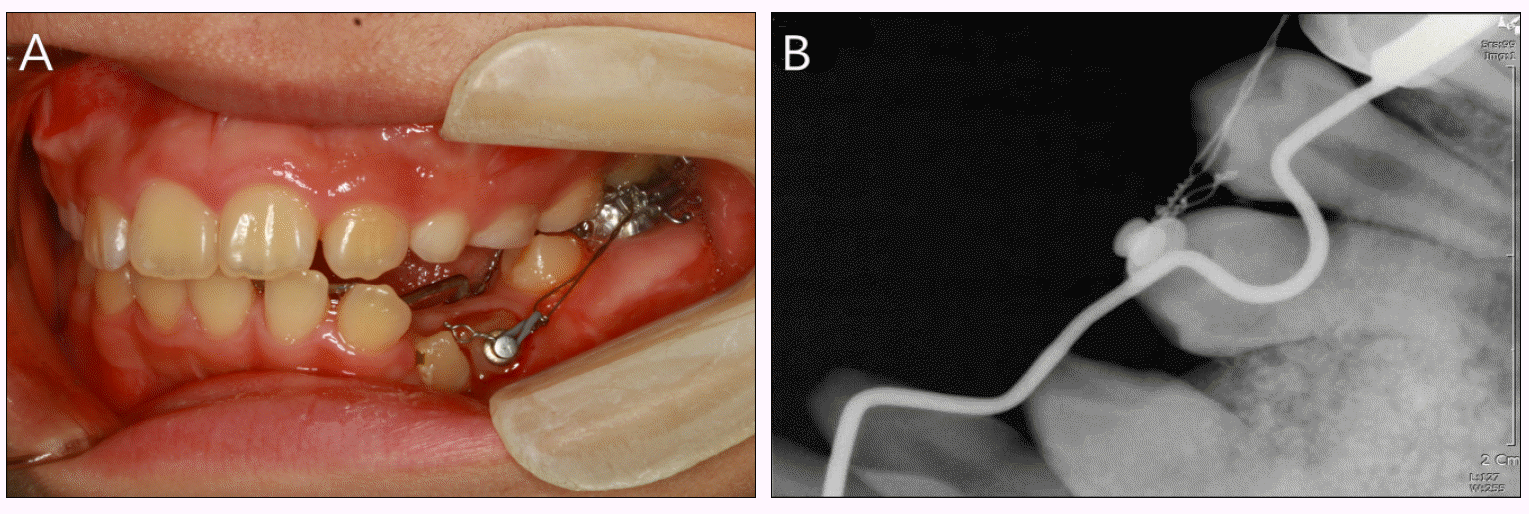
Fig.┬Ā6.
(A, B) Intraoral photograph of 3 years after surgery. Extracted lower left canine was put into position by preparing the reimplantation site at the apical end of the socket to accommodate the tooth in the new position. (C) Panoramic view of 3 years after surgery. Radiographically, no cystic lesion was detected and new bone formation is observed.
REFERENCES
1. Gorlin RJ : Nevoid basal cell carcinoma (Gorlin) syndrome: unanswered issues. J Lab Clin Med, 134:551-552, 1999.


2. Nicolatou O, Kakarantza-Angelopoulou E : Odontogenic keratocysts: clinicopathologic study of 87 cases. J Oral Maxillofac Surg, 48:593-599, discussion 599-600. 1990.


3. Howell JB, Caro MR : The basal-cell nevus: its relationship to multiple cutaneous cancers and associated anomalies of development. AMA Arch Derm, 79:67-77, discussion 77-80. 1959.


5. Howell JB, Anderson DE : ŌĆ£The basal-cell nevusŌĆØ by Howell and Caro, January 1959. Commentary: The nevoid basal cell carcinoma syndrome. Arch Dermatol, 118:813-826, 1982.


6. Ahn SG, Lim YS, Kim DK, et al. : Nevoid basal cell carcinoma syndrome: a retrospective analysis of 33 affected Korean individuals. Int J Oral Maxillofac Surg, 33:458-462, 2004.


7. Evans DG, Ladusans EJ, Rimmer S, et al. : Complications of the nevoid basal cell carcinoma syndrome: results of a population based study. J Med Genet, 30:460-464, 1993.



8. Southwick GJ, Schwartz RA : The basal cell nevus syndrome: disasters occurring among a series of 36 patients. Cancer, 44:2294-2305, 1979.


9. Stoelinga PJ, Peters JH, van de Staak WJ, et al. : Some new findings in the basal-cell nevus syndrome. Oral Surg Oral Med Oral Pathol, 36:686-692, 1973.


10. Myoung H, Hong SP, Hong SD, et al. : Odontogenic keratocyst: Review of 256 cases for recurrence and clinicopathologic parameters. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 91:328-333, 2001.


11. Gorlin RJ, Sedano HO : The multiple nevoid basal cell carcinoma syndrome revisited. Birth Defects Orig Artic Ser, 7:140-148, 1971.
12. Howell JB : Nevoid basal cell carcinoma syndrome. Profile of genetic and environmental factors in oncogenesis. J Am Acad Dermatol, 11:98-104, 1984.


13. R Yang X, Pfeiffer RM, Goldstein AM : Influence of glutathione-S-transferase (GSTM1, GSTP1, GSTT1) and cytochrome p450 (CYP1A1, CYP2D6) polymorphisms on numbers of basal cell carcinomas (BCCs) in families with the naevoid basal cell carcinoma syndrome. J Med Genet, 43:16, 2006.



14. Cohen MM Jr : Nevoid basal cell carcinoma syndrome: molecular biology and new hypotheses. Int J Oral Maxillofac Surg, 28:216-23, 1999.


15. Brannon RB : The odontogenic keratocyst. A clinicopathologic study of 312 cases. Part I. Clinical features. Oral Surg Oral Med Oral Pathol, 42:54-72, 1976.


16. Nakamura N, Mitsuyasu T, Mitsuyasu Y, et al. : Marsupialization for odontogenic keratocysts: longterm follow-up analysis of the effects and changes in growth characteristics. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 94:543-553, 2002.


17. Pogrel MA : Decompression and marsupialization as a treatment for the odontogenic keratocyst. Oral Maxillofac Surg Clin North Am, 15:415-427, 2003.


18. Ninomiya T, Kubota Y, Koji T, et al. : Marsupialization inhibits interleukin-1alpha expression and epithelial cell proliferation in odontogenic keratocysts. J Oral Pathol Med, 31:526-533, 2002.


19. Nakamura N, Mitsuyasu T, Mitsuyasu Y, et al. : Marsupialization for odontogenic keratocysts: longterm follow-up analysis of the effects and changes in growth characteristics. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 94:543-53, 2002.


20. Thomas M, Tackett JC, Desai P : The incredible odontogenic keratocyst. N Y State Dent J, 58:31-3, 1992.
21. Loescher AR, Robinson PP : The effect of surgical medicaments on peripheral nerve function. Br J Oral Maxillofac Surg, 36:327-32, 1998.


22. Valentini P, Abensur D, Densari D, et al. : Histological evaluation of Bio-Oss in a 2-stage sinus floor elevation and implantation procedure. A human case report. Clin Oral Implants Res, 9:59-64, 1998.


- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 7,365 View
- 66 Download
- Related articles
-
Oral Features in a Child with Noonan Syndrome : A Case Report2018 February;45(1)
Stevens-Johnson Syndrome : A Case Report2017 November;44(4)
Dental Treatment of a Wolf-Hirschhorn Syndrome Patient: A Case Report2016 August;43(3)
Nevoid Basal Cell Carcinoma Syndrome : A Case Report2014 February;41(1)




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print