한국 소아∙청소년의 타액과 치태 내 치주 병원균 출현율
Prevalence of Periodontopathogens in Saliva and Plaque of Korean Children and Adolescents
Article information
Abstract
소아에서 치주 병원균의 조기 집락은 향후 치주 질환으로 발전될 위험 인자로 작용할 수 있으므로 원인균의 조기 진단과 예방이 최선의 치료라 할 수 있다. 이 연구는 치주적으로 건강한 어린이와 청소년에서 타액과 치태를 채취하고, PCR을 사용하여 주요 치주 질환 원인균 5종의 분포 정도를 조사하였으며, 나아가 타액과 치태의 검출 차이를 비교 분석하였다.
A. actinomycetemcomitans와 P. intermedia는 고등학생(만17세)에서, T. forsythia와 F. nucleatum는 초등학생(만8세)에서 가장 많이 검출되었다. 반면, P. gingivalis는 모든 대상에서 발견되지 않았다. 그리고 치은연상치태보다 타액에서 유의하게 검출이 더 잘 된 것으로 나타났다.
치주 병원균이 상대적으로 더 많이 검출된 청소년기에서는 치주 질환 예방을 위한 구강위생교육이 더욱 강화될 필요가 있으며, 치주 질환의 조기진단 및 관련 연구에 있어서 타액은 보다 유용한 도구가 될 것이라 사료된다.
Trans Abstract
Early colonization of periodontal pathogens has been related as a risk indicator for the subsequent development of periodontal disease. Such colonization can be easily detected with mediums like saliva and plaque. This study aimed to evaluate the prevalence of the bacteria associated with periodontal disease in saliva and plaque in healthy children and adolescents. The experiment was conducted using 90 samples from subjects consisting of thirty elementary school students, thirty high school students and thirty adults. PCR was used to detect the prevalence and distribution of five periodontal pathogens in the collected saliva and plaque. The detected periodontal pathogens are as follows: A. actinomycetemcomitans, P. gingivalis, T. forsythia, F. nucleatum and P. intermedia. Periodontal pathogens were prevailed in a higher number of adolescents than the number of children. A. actinomycetemcomitans and P. intermedia were detected the most in the adolescents group. T. forsythia and F. nucleatum were detected the most in the children group. The overall result showed that saliva is more a useful medium than supragingival plaque. The detection of high risk periodontal pathogens in children and adolescents without clinical signs of periodontal disease can emphasize the importance of the early diagnosis and preventive approach.
Ⅰ. 서 론
치주 질환은 여러 미생물에 의한 다중 감염이자 숙주 반응과의 상호 작용의 결과로서, 세균이 주된 병인으로 제시되어 왔다[1]. 소아청소년에서 치주조직의 염증성 반응은 흔하게 관찰되지만, 치아 지지조직의 부착 소실 및 파괴를 동반하는 치주 질환은 성인에 비해 드물게 발생한다고 보고되었다[2]. 그러나 치주 병원균의 조기 집락은 향후 치주 질환으로 발전될 위험인자로 작용할 수 있으므로, 원인균의 조기 진단과 예방적 접근이 최선의 치료라 할 수 있다[3].
치주 병원성 세균 중에서 Aggregatibacter actinomycetemcomitans (A. actinomycetemcomitans)는 급진성 치주염 및 초기 발병 치주염과 밀접한 관련이 있으며, Tannerella forsythia (T. forsythia)와 Porphyromonas gingivalis (P. gingivalis)는 red complex에 속하는 세균으로서 치주조직의 파괴와 가장 강한 연관성을 가진다고 알려져 있다. 또한, Fusobacterium nucleatum (F. nucleatum)와 Prevotella intermedia (P. intermedia)도 일반적으로 치주염에 이환된 모든 대상에서 발견된다고 하였다[4,5].
치주 병원균에 대한 기존 연구들은 대부분 치은 연하 치태의 분석을 통하여 이루어져 왔으나, 치은 연상 치태에서 치은 연하 치태와 유사한 세균 조성이 관찰되면서 획득의 편이성과 함께 진단학적 가치가 제시되었다[6,7]. 근래에는 타액도 치주 병원균의 분석에 있어서 유용한 도구로 평가받고 있는데, 다양한 구강 부위에서 유래하는 여러 세균을 포함하면서 비교적 쉽고 빠르게 채득 가능하기 때문이다[3].
중합효소연쇄반응(Polymerase Chain Reaction, PCR)은 특이적인 primer를 사용하여 적은 수의 세균도 민감하게 검출할 수 있는 분석법으로서, 타액이나 치태를 사용한 여러 치주 질환 연구에 활용되어 왔다[8]. 그러나 국내에서 어린이와 청소년의 치주 질환 원인균에 대한 연구는 많지가 않으며, 특히 타액을 진단 도구로 사용한 보고는 더욱 미비한 실정이다. 이 연구는 PCR을 사용하여 건강한 어린이와 청소년에서 주요 치주 질환 원인균 5종의 분포 정도를 조사하고, 나아가 타액과 치태의 출현율 차이를 비교 분석하고자 하였다.
Ⅱ. 연구 대상 및 방법
1. 연구 대상
이 연구는 전주시에 거주하고 특별한 의과적 병력이 없으며, 탐침시 출혈이나 치주낭이 없는 치주적으로 건강한 세 그룹의 모집단을 대상으로 실시되었다. Group 1은 초등학교 2학년 학생 30명(만8세, 남 15명, 여 15명), group 2는 고등학교 2학년 학생 30명(만17세, 남 15명, 여 15명), group 3은 전북대학교 치과병원에 내원한 20대 성인 30명(만28.4세, 남 15명, 여 15명)이었다. 이들은 모두 아침 식사 후 양치질을 시행하고 검사 전까지 음식이나 음료를 섭취하지 않은 자들로 한정하였으며 오전 9-10시 사이에 타액, 치태 채취 및 구강검사를 실시하였다.
연구 대상자가 미성년자인 경우에는 연구 대상자 및 보호자에게 실험의 목적과 방법을 상세하게 설명하였고, 미리 동의서와 설문지를 얻은 후 연구를 진행하였다. 이 연구는 전북대학교병원 임상연구윤리위원회(Institutional Review Board, IRB)의 지침에 따라 수립하였으며 심의 절차 과정을 통과하였다(IRB번호 : 2014-08-004-001).
2. 연구 방법
1) 타액 및 치은연상치태 채취
연구 대상자들로 하여금 파라핀 정제(paraffin tablet)를 저작하게 하고 동일한 검사자가 플라스틱 용기에 자극성 타액을 약 5-10 mL 수집하였다. 또한 멸균된 면봉을 이용하여 가벼운 힘으로 제1대구치 협면에서 치태를 채취하였다. 획득한 타액과 치태는 4℃ 이하의 아이스박스에 보관하여 운반하였으며 채취 당일에 분석을 실시하였다.
2) PCR을 이용한 치주 질환 연관 세균의 존재유무 조사
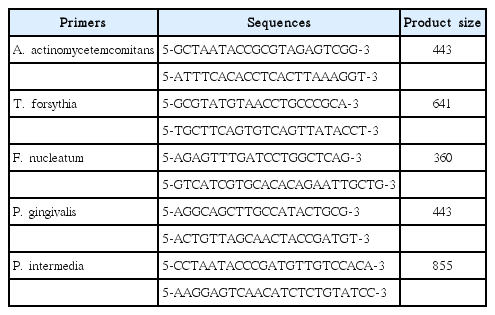
PCR을 이용하여 타액과 치태 내의 치주 질환 연관 세균 5종(A. actinomycetemcomitans, T. forsythia, F. nucleatum, P. gingivalis, P. intermedia)의 존재 유무를 확인하였다. 각 세균의 특정 서열을 증폭시키는데 사용된 primer 목록은 Table 1과 같다.
PCR 실험을 위한 혼합물의 총 부피는 20 μL이고, DNA 1 μL, 5 × PCR mixture 4 μL (ELPIS, Daejeon, Korea), 5 pM primer 1 μL, 증류수 14 μL로 이루어졌다. PCR 반응은 95℃에서 5분간 전체 DNA를 변성(denaturation)시키고, 95℃에서 10초간 변성, 58℃에서 10초간 primer 결합(annealing), 72℃에서 10초간 DNA를 증폭(extension)하는 과정을 30회 시행하였으며, 그 후 72℃에서 5분간 더 증폭하였다. PCR 산물을 1% 아가로스 젤에서 분리하고 Ethidium Bromide (EtBr)로 염색하여 분석하였다.
3) 통계 분석
PCR을 이용한 5종의 치주 질환 연관세균의 출현율 및 관련 자료들을 SPSS 19.0 프로그램을 사용하여 분석하였다. 타액과 치태에 따른 세균 출현율의 차이가 통계학적으로 유의한지 알아보기 위해 Independent t-test, Analysis of Variance (ANOVA)를 사용하였고, 유의 수준은 p < 0.05를 기준으로 하였다.
Ⅲ. 연구 성적
1. PCR을 이용한 타액 내의 치주 질환 연관 세균 출현율 평가
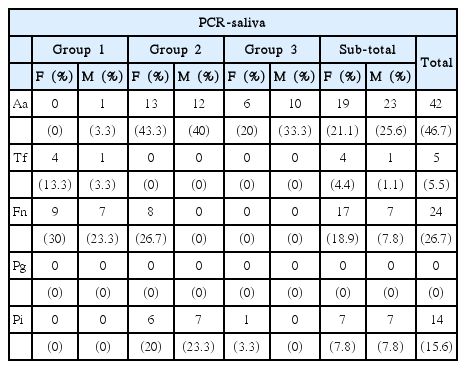
PCR을 이용하여 타액과 치은연상치태에서 치주 질환 연관 세균 5종(A. actinomycetemcomitans, T. forsythia, F. nucleatum, P. gingivalis, P. intermedia)의 존재유무를 비교하였다. 타액의 치주 질환 연관 세균에 대한 조사 결과, group 2(고등학생)에서 A. actinomycetemcomitans 83.3%, P. intermedia 43.3%가 검출되어 남녀 모두에서 가장 많이 나타났다. Group 1(초등학생)에서 T. forsythia 16.6%, F. nucleatum 53.3%가 검출되어 남녀 모두에서 가장 많이 나타났고 P. gingivalis는 모든 대상에서 검출되지 않았다(Table 2).
2. PCR을 이용한 치은 연상 치태 내의 치주 질환 연관 세균 출현율 평가
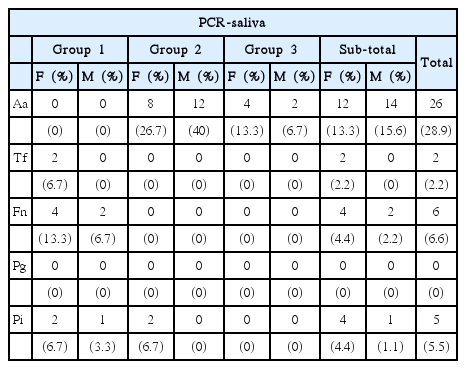
치은 연상 치태의 치주 질환 연관 세균에 대한 조사 결과, group 2 (고등학생)에서 A. actinomycetemcomitans 66.7%가 검출되어 남녀 모두에서 가장 많이 나타났다. Group 3 (성인)에서는 A. actinomycetemcomitans 20%가 검출되었고 T. forsythia, F. nucleatum은 group 1(초등학생)에서만 6.7%, 20%가 검출되었으며 P. gingivalis는 모든 대상에서 검출되지 않았다(Table 3).
3. 타액과 치은 연상 치태 내의 치주 질환 연관 세균 출현율 비교
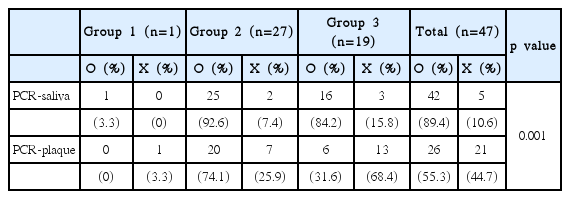
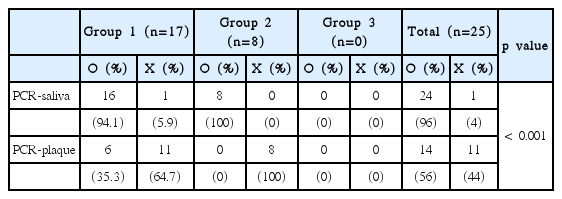
총 90명 중 A. actinomycetemcomitans는 47명에서 검출되었고 47명 중 타액에서 검출되었으나 치은 연상 치태에서 검출되지 않은 사람은 21명(44.7%), 치은 연상 치태에서 검출되었으나 타액에서 검출되지 않은 사람은 5명(10.6%)이었다(Table 4). F. nucleatum은 총 90명 중 25명에서 검출되었고 25명 중 타액에서 검출되었으나 치은 연상 치태에서 검출되지 않은 사람은 11명(44.0%), 그 반대는 1명(4.0%)이었다(Table 5).
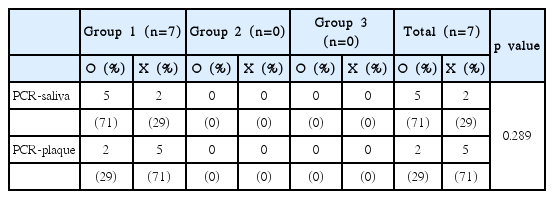
P. intermedia는 총 90명 중 17명에서 검출되었고 17명 중 타액에서 검출되었으나 치은 연상 치태에서 검출되지 않은 사람은 12명(70.6%), 그 반대는 1명(17.6%)이었다(Table 6). T. forsythia는 총 90명 중 7명에서 검출되었고 7명 중 타액에서 검출되었으나 치은 연상 치태에서 검출되지 않은 사람은 5명(71.0%), 그 반대는 2명(29.0%)이었다(Table 7).
이 중 A. actinomycetemcomitans, P. intermedia, F. nucleatum는 타액에서의 검출이 치은 연상 치태보다 유의하게 높게 나타났다(A. actinomycetemcomitans; p < 0.01, P. intermedia; p < 0.05, F. nucleatum; p < 0.001).
Ⅳ. 총괄 및 고찰
어린이와 청소년의 치주 질환은 성인과 비교시 파괴적인 형태를 보이는 유병률은 낮지만, 조기 발병, 빠른 진행, 특정 미생물 군, 국소적인 병소 등 성인의 치주 질환과는 다른 독립적인 특성을 가진다고 알려져 있다[9,10]. 치주 질환 병력을 가진 어린이는 성인에서도 치주 질환에 이환될 가능성이 높으며, 소아에서 P. gingivalis와 P. intermedia의 조기 집락화는 이후 치주 질환으로 진행될 위험성을 나타낸다고 보고되었다[11]. 그러므로 소아청소년기에서 치주조직의 염증성 반응에 대한 조기 진단 및 예방적 접근은 매우 중요하다[12].
건강한 사람의 구강 내에 상주하는 정상 세균총은 서로 균형을 이루고 있으나 어떤 요인에 의해 균형이 무너질 때 특정 구강 질환의 발병 가능성이 높아진다고 하였다[13]. 치주 질환은 한 가지 미생물에 의해서 발생되는 몇몇 감염성 질환과는 달리 여러 종류의 세균이 복합적으로 관련되어 있고, 이러한 세균이 치아에 축적되어 치태를 형성함으로써 발생한다고 알려져 있다[4]. 따라서 관련 병원균에 대한 정성적, 정량적 분석은 치주 질환의 조기 진단과 효과적인 치료에 있어서 필수적인 부분으로 사료되었다.
일반적으로 어린이와 청소년에서는 급진성 치주염이 더 흔하며 성인에서는 만성 치주염이 더 흔한 양상을 보인다[9,14]. 급진성 치주염 및 초기 발병 치주염의 병인은 주로 A. actinomycetemcomitans와 밀접하게 관련된다고 알려져 있고, 만성 치주염의 병인은 주로 P. gingivalis와 관련된다고 보고되었다. 또한 P. gingivalis는 T. forsythia와 함께 치주조직의 파괴와 가장 강한 연관성을 가지는 병원균으로 알려져 있다. 한편 F. nucleatum와 P. intermedia는 치주염을 가진 환자에서 흔히 검출되었다[12,15,16]. 이 연구는 치주적으로 건강한 대상으로부터 이들 치주 병원균 5종의 출현율과 연령대별 분포를 조사하였다.
이 연구에서 A. actinomycetemcomitans는 청소년에서 획득된 타액과 치은 연상 치태 모두에서 가장 많이 검출되었다. 치주적으로 건강한 대상에서 A. actinomycetemcomitans의 출현율을 조사한 연구들에 따르면 4.8%에서 50%까지 다양하게 보고되었다[17,18]. 국내에서 Kim 등[12]이 8-18세를 대상으로 실시한 연구에서는 A. actinomycetemcomitans가 15.4%로 나타났고, 최근 4-6세에 대한 조사에서는 5.7%로 보고되었는데[19], 이 연구에서는 A. actinomycetemcomitans 출현율이 청소년에서 상당히 높게 나타났다. A. actinomycetemcomitans는 다른 혐기성균보다 일찍 구강 내에 집락화하는 것으로 보이고, 제1대구치가 맹출하는 시기에 치주적으로 건강한 어린이들의 약 10%에서 나타나기 시작하며, 이러한 결과는 치아의 맹출이 A. actinomycetemcomitans의 집락화에 적합한 환경을 제공하는 것이라고 보고되었다[4,20].
청소년기에는 성호르몬 증가로 인하여 사춘기 전 어린이나 성인에 비해 치은염 유병률이 더 높게 나타나며 성호르몬의 변화는 미생물 구성에 영향을 줄 수 있다고 보고된 바 있는데, 혈청 내 testosterone, 또는 estradiol, progesterone의 수치 증가는 치주 병원균인 Prevotella intermedia와 Capnocytophaga의 증가와 관련 있다고 하였다[21,22]. 이 연구에서 청소년으로부터 획득한 타액에서 P. intermedia가 두 번째로 높은 빈도로 관찰되었던 점도 이러한 성호르몬 변화와 연관되어 있다고 사료되었다.
P. gingivalis는 모든 연구 대상에서 검출이 되지 않았는데, 이는 건강한 대상이나 치은염 환자에서는 드물게 관찰되고 진행된 파괴성 치주 질환에서 더 많이 발견된다는 기존의 연구 결과들과 일치하였다[12,23]. 또한 치주상태와 P. gingivalis의 관계를 평가한 보고에 따르면, 치주낭의 깊이가 증가할수록 P. gingivalis의 상대적 양이 증가한다고 하였다[24]. 이를 통해 치주 상태를 평가하는데 있어서 P. gingivalis의 존재 및 상대적 양을 측정하는 것은 중요한 척도가 될 수 있다고 사료되었다. 한편 치주적으로 건강한 소아를 대상으로 T. forsythia와 F. nucleatum의 출현율을 분석한 연구들에 따르면 T. forsythia는 20-50%, F. nucleatum은 최대 100%까지 다양하게 보고되었으며[12], 이 연구에서는 소아의 타액 내에서 T. forsythia가 16.6%, F. nucleatum가 53.5%로 가장 많이 검출되었다.
치주 병원균의 조성은 일반적으로 연령, 인종, 교육 수준, 치열 발육 단계, 치주상태, 식이습관, 구강 위생 상태, 숙주 면역계, 성호르몬 등에 따라 다양하게 보고되어 왔다[4,25]. 이번 연구에서는 인종, 연령, 교육 수준, 치열 단계 등의 관련 요인을 통제하고자 동일한 학교에서 교육을 받는 같은 학년의 또래들을 한 집단으로 분류하였고, 연령, 호르몬 및 치열 단계에 따른 집단간 차이를 비교하고자 소아, 청소년, 성인 집단으로 분류하였다. 그러나 식이습관, 구강 위생 상태, 면역체계의 성숙도에 따른 변화는 반영되지 못하였고, 이러한 한계점은 추가적인 연구를 통해 보완해야 할 것이다.
구강 내에서 치주 병원균이 존재하는 주된 위치는 치은 연하이므로 치주 질환 관련 세균에 대한 기존 연구들은 대부분 치은 연하 치태의 분석을 통하여 이루어져 왔다. 그러나 치은 연상 치태와 치은 연하 치태의 치주 병원균 조성은 서로 유사하며 치은 연상 치태가 치은 연하 치태의 미생물학적 특성을 반영한다는 연구 결과가 보고되면서, 치은 연상 치태의 진단학적 가치에 관심을 가지게 되었다[6,7]. 또한 치태를 사용한 세균총의 분석은 획득되는 구강 내 위치에 따라 다른 결과를 나타낼 수 있다는 한계점이 제시됨에 따라, 타액을 이용한 진단학적 분석법이 새롭게 활용되게 되었다[26]. 타액은 소아에서 상대적으로 쉽고 빠르게 채취 가능한 시료로서, 서로 다른 구강 부위에서 유래하는 다양한 세균들을 포함하기 때문에 치주 병원균의 검출에 있어서 유용한 도구로 평가받고 있다[3].
타액, 치은 연상 치태, 치은 연하 치태에서의 세균 분포를 분석한 연구에 따르면 서로 유의한 연관성을 가지면서 유사한 분포를 나타냈다[27-29]. 또한 타액과 치태의 치주 질환 세균 검출능을 비교한 여러 보고들을 종합해보면, 타액을 이용한 검출이 치태보다 조금 더 우위에 있다는 연구들이 많았다[30,31]. 이 연구에서도 타액과 치은 연상 치태 내의 치주 병원균 출현율을 비교한 결과, A. actinomycetemcomitans, F. nucleatum, P. intermedia는 치은연상치태보다 타액에서 더 잘 검출되었다. 이는 특정 치면에서 획득된 치태가 구강 세균총의 전반적인 특성을 나타내기에는 부족하며, 타액이 저장소로서 혐기성 세균들도 서식 가능한 특성을 가진다는 연구 결과와 연관 있을 것으로 사료되었다[26]. 따라서 조기 진단 및 치료 경과 관찰의 목적으로 타액 분석을 주목하는 것은 의미가 있을 것이다.
PCR과 같은 분자적 기술을 활용한 타액의 미생물학적 분석은 치주 질환 원인균에 대한 보다 효과적인 분석을 제공하였다. 최근에는 real-time PCR을 통하여 치주 병원성 세균에 대한 정성적, 정량적 분석이 가능해졌다. 전통적인 방식의 PCR과 real-time PCR을 비교한 여러 연구들에 따르면, 두 방법을 사용한 치주 병원균의 출현율 결과는 상당한 일치성을 보였을 뿐 아니라 real-time PCR이 더 민감한 방법이라고 주장되었다[31,32]. 이 연구에서는 전통적인 방식의 PCR만을 사용하였는데, 이는 양적 평가가 어려운 한계를 가진다고 하였다[8]. 추후의 연구에서는 real-time PCR을 사용하여 정량적 분석 결과를 보완하고자 한다.
다른 한계점으로는 치은 연상 치태와 타액만을 비교 분석하였다는 점이다. 치은 연하 치태까지 세 가지 표본을 비교하고 치주 질환 원인균 분석에 더 적합한 검사법을 찾는다면, 보다 의미 있는 연구가 될 것이라고 사료되었다. 또한 치주 질환에서는 세균 이외의 다양한 내인성, 외인성 요인들도 중요하게 작용하므로[18,33,34], 관련 요인들을 정리하고 상관관계를 분석한다면 향후 연구에 보다 기여하리라 사료된다.
치주 질환, 치주 병원균 및 타액 진단 검사를 고려할 때, 자연스럽게 성인에 집중하는 경향이 있다. 이제는 소아청소년으로 시각을 넓혀서 조기 진단 검사, 정기적인 구강 위생 교육 등 예방적 접근을 시도하는 것도 의미가 있을 것으로 사료된다.
Ⅴ. 결 론
이 연구는 치주적으로 건강한 어린이와 청소년에서 치주 병원균의 출현율을 알아보고 타액과 치태의 검출능을 비교분석하기 위하여, 전주시에 거주하는 초등학생(group 1, 만8세), 고등학생(group 2, 만17세) 및 성인(group 3, 만28.4세), 총 90명을 대상으로 타액과 치태를 채취하였다. 그리고 치주 질환 연관 세균 5종(A. actinomycetemcomitans, T. forsythia, F. nucleatum, P. gingivalis, P. intermedia)의 존재유무를 PCR을 사용하여 평가하고 다음과 같은 결론을 얻었다.
PCR을 이용하여 타액과 치은 연상 치태 내의 치주 질환 연관 세균의 존재유무를 비교한 결과, 치주 질환 연관 세균은 group 2에서 A. actinomycetemcomitans, P. intermedia가 가장 많이 검출되었으며, group 1에서 T. forsythia, F. nucleatum가 가장 많이 검출되었다. 반면, P. gingivalis는 모든 대상에서 발견되지 않았다. 그리고 치은 연상 치태보다 타액에서 유의하게 검출이 더 잘 된 것으로 나타났다.
치주 질환의 주요 병원균이 상대적으로 더 많이 검출된 청소년기에서는 치주 질환 예방을 위한 구강 위생 교육이 더욱 강화될 필요가 있으며, 치주 질환의 조기 진단 및 관련 연구에 있어서 타액은 보다 유용한 도구가 될 것이라 사료된다.