혈액 오염 처리 과정이 교정용 브라켓 접착에 미치는 영향
Effect of Blood Decontamination on Orthodontic Bracket Bonding
Article information
Abstract
혈액 오염 처리 과정은 교정용 브라켓 부착 성공에 중요한 요소이다. 본 연구의 목적은 교정용 브라켓 접착 중 발생할 수 있는 오염 처리 과정에 따른 영향을 알아보고자 함이다. 이에 프라이머 광중합 전과 후에 혈액 오염이 되었을 때 세척 방법에 따라 전단 결합 강도에 미치는 영향을 평가해보고, 접착 파절 형태 및 표면 양상을 주사전자 현미경을 이용하여 관찰해보고자 하였다.
50개의 소구치를 대상으로, Ⅰ군은 대조군으로 전통적인 산부식 방법으로 부착하였다. Ⅱ군과 Ⅲ군은 프라이머 광중합 전에, Ⅳ군과 Ⅴ군은 프라이머 광중합 후에 혈액 오염이 일어난 군으로 나누었다. 또한 Ⅱ군과 Ⅳ군은 코튼 펠렛만 이용하여, Ⅲ군과 Ⅴ군은 수세 후 코튼 펠렛을 이용하여 세척하였다.
그 결과 평균 전단 결합 강도는 Ⅰ군, Ⅴ군, Ⅲ군, Ⅱ군 그리고 Ⅳ군 순으로 나타났다. 또한 주사 전자 현미경 사진 상에서 수세 후 코튼 펠렛으로 닦은 군이 코튼 펠렛으로만 처리한 군에 비해 균일한 산부식 표면을 보였다. 접착제 잔류지수는 대조군과 실험군 간에 유의차가 있었다(p < 0.05).
Trans Abstract
Blood decontamination is an important factor in success of the orthodontic bracket. The purpose of this study is to evaluate the shear bond strength affected by blood decontamination. The shear bond strength was measured on blood decontamination before and after primer photopolymerization. And the adhesive remnants type and surface patterns was evaluated under scanning electron microscopy.
A total of 50 human premolars were prepared. Group Ⅰ was attached using conventional resin-acid etching method as control group. Group Ⅱ and Ⅲ were blood contaminated before curing primer and groups Ⅳ and Ⅴ were blood contaminated after curing primer. Group Ⅱ and Ⅳ were treated only with cotton pellet and Groups Ⅲ and Ⅴ were treated with cotton pellet after water washing.
The mean shear bond strengths were in the order of groups Ⅰ, Ⅴ, Ⅲ, Ⅱ, and Ⅳ. In scanning electron micrographs group III and V showed more uniform surface than group II and IV. The ARI was significantly different between the control group and the experimental groups (p <0.05).
Ⅰ. 서 론
치아는 점차 발육함에 따라 맹출 전 이동, 골내 이동 등의 여러 과정을 거친 후 구강 내로 맹출 하게 된다. 하지만 치아가 정상 시기에 맹출 되지 않거나, 이소 맹출 될 경우 인접 치아의 교정적 문제 및 치근 흡수, 심미적 문제, 공간 상실로 인한 부정교합 등을 유발시킬 수 있다. 맹출 장애의 치료에는 미맹출 치아의 제거, 외과적 노출, 교정력을 이용한 맹출 유도, 자가 치아 이식 등이 있다[1]. 그 중 교정력을 이용한 미맹출 치아의 맹출 유도는 치아 교환이 되고 있는 소아, 청소년 시기에 치아가 정상 맹출로로 성공적인 배열이 가능하도록 할 수 있다. 보통 개창술(window opening)을 동반하며 치면을 노출시키고 브라켓을 부착하여 해당 치아에 정출력을 가하게 된다.
하지만 개창술 시행 시 접근과 방습이 어려운 경우가 많아 타액, 혈액 및 수분 등 오염의 위험성이 수술적 접근이 필요한 매복치 치료 시 일어나게 된다. 이는 이상적인 접착 환경을 만들어 주지 못하여 결합 강도를 유의하게 감소시키며 이는 브라켓 접착 실패의 원인이 된다[2-5]. 이러한 접착의 실패 및 그로 인한 재부착으로 진료시간의 증가 및 추가 비용 등이 생기며, 추후 치료 결과에도 부정적인 영향을 미치게 된다. 치아의 산부식은 법랑질의 결정 구조를 용해시켜 프리즘을 노출시키게 되며 이로 인해 생긴 미세 기계적 유지를 이용하여 레진 접착이 이루어진다. 하지만 타액 혹은 혈액이 수초 내에 세척되지 않으면 부착 유기물 막이 생겨 법랑질 표면의 오염이 일어나게 된다[5]. 이런 오염으로 많은 연구에서 유의하게 전단 결합 강도의 감소가 관찰되었다[6-8].
혈액 오염은 브라켓 접착의 어느 단계에서 일어날 수 있으며 법랑질 표면의 오염에서 두 가지의 주요한 시간적 접착 단계가 있다. 첫 번째는 산부식 후로 프라이머 적용 전 단계이고, 두 번째로는 프라이머 도포 후의 단계이다. 프라이머 도포 전에 오염이 될 경우 smear layer의 형성으로 표면 에너지를 감소시켜 유의하게 전단 결합 강도의 감소가 일어난다는 연구 결과가 보고된 바가 있다[9]. 그리고 프라이머 도포 후에 타액 및 습윤 상태의 오염이 브라켓의 결합 강도에 미치는 영향에 대해서 연구가 보고되었지만 혈액의 오염에 대한 연구는 상대적으로 부족한 실정이다[10]. 또한 혈액이 오염 되었을 경우 세척하는 것이 임상적으로 유효한 치아 접착력을 얻는데 중요하지만 세척 방법이 교정용 브라켓의 전단 결합 강도에 미치는 영향에 대한 연구는 미미하다.
이에 본 연구에서 프라이머 도포 후, 광중합 전에 혈액이 오염 여부가 세척 방법에 따라 전단 결합 강도에 미치는 영향을 평가해보고, 접착 파절 형태 및 표면 양상을 관찰한 결과 다소의 지견을 얻었기에 보고하는 바이다.
Ⅱ. 연구 재료 및 방법
1. 연구 재료
1) 실험 대상 치아
치아는 치관 협면이 건전한 법랑질을 가진 우식, 충전물, 파절, 균열 그리고 결손 부위가 없는 50개의 발거된 사람의 상하악 소구치를 이용하였다. 발거 직후 치아면의 탈수를 막기 위하여 멸균된 증류수에 넣어 상온에 보관하였다.
2) 실험 재료
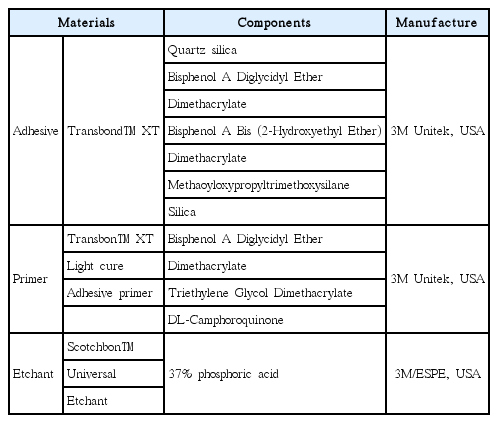
광중합형 교정용 레진 접착제인 Transbond™ XT (3M Unitek, USA)를 사용 하였고, 법랑질 표면 처리제로는 Transbond™ XT Light cure Adhesive primer (3M Unitek, USA)를 사용했으며, 산 부식에는 37% 인산(3M, USA)을 사용하였다(Table 1). 또한 교정용 브라켓은 매쉬 형태의 곡면이 있는 직경 3.5 mm, 면적 9.62 mm2 의 교정용 버튼(Tomy, Japan)을 사용하였다. 광중합기는 Elipar FreeLight2 (3M ESPE, USA)를 사용하였으며 치아 10개마다 Radiometer (dentAmerica, USA)를 이용하여 광원의 조도가 470 nm 이상으로 일정하게 유지되는지 확인하였다. 혈액은 의학적 병력이 없는 건강한 한 사람의 정맥혈을 6 cc 채취하여 항응고제를 포함하는 용기에 보관 후 채혈 즉시 실험에 사용하였다.
2. 연구 방법
1) 대상 치아의 준비 및 시편 제작
총 50개의 치아 표면의 치석, 이물질 및 유기물질을 스케일러로 제거한 후, 불소가 포함되지 않은 퍼미스를 이용하여 세척하고, 실온의 멸균 증류수에 보관하였다. 준비된 치아는 고속 핸드피스를 이용하여 치근 중앙부를 절단한 후 시편 제작 전까지 멸균 증류수에 보관하였다.
실험 치아의 고정을 위하여 123Design (Autodesk®, USA) 프로그램으로 가로 22.7 mm, 세로 17.3 mm, 높이 12 mm로 일정한 크기의 주형을 디자인하여 3D 프린터(Deltas Kit 250, S3D, Korea)로 Poly lactic acid 주형을 제작하였다(Fig. 1, 2). 주형에 준비된 치아 치관의 순면만 보이게 아크릴릭 레진으로 매몰을 시행하였으며, 최대한 하면과 치면과 하면이 평행하게 매몰을 시행하였다. 매몰 후, 레진의 경화열을 분산시키기 위해 실온의 멸균 증류수에 담가 경화가 일어나는 동안 30분간 보관하였다. 매몰 후에 법랑질 표면에 직경 4.5 mm 이상의 평면이 만들어질 때까지 순차적으로 320, 600, 1200 grit 실리콘 카바이드 페이퍼로 연마하고 치아의 탈수를 막기 위해 다시 멸균 증류수에 보관하였다.
2) 실험군의 분류
총 50개의 치아를 무작위로 10개씩 5개의 군으로 분류하였다(Table 2). 모든 군은 공통적으로 30초간 산부식 후, 각각 5초간 수세와 건조를 시행하였다. 대조군인 Ⅰ군으로 혈액 오염이 없는 통상적인 산부식 접착 시스템을 이용하여 교정용 버튼을 부착하였다. Ⅱ군과 Ⅲ군은 프라이머 광중합 전에 혈액 오염이 되었다고 가정한 군으로 프라이머 도포 후 각 치아 당 혈액 2방울 씩 적용한 후, 혈액이 충분히 스며들 수 있도록 1분간 유지하였다. Ⅱ군은 오염된 혈액을 코튼 펠렛만 이용하여 3번씩 닦아주었으며, Ⅲ군은 5초간 수세 후, 코튼 펠렛을 이용하여 3번씩 닦아주었다. 그 후 오염된 혈액이 제거된 시편에 프라이머를 재도포하고 광중합 후, 버튼 부착을 시행하였다. Ⅳ군과 Ⅴ군은 프라이머 광중합 후에 혈액이 오염되었다고 가정한 군으로, 통상적인 방법으로 프라이머 광중합 후 혈액 2방울씩 적용한 후, 1분간 유지하였다. Ⅳ군은 코튼 펠렛만 이용하여 3번씩 오염 표면을 닦아주었으며, Ⅴ군은 5초간 수세 후, 코튼 펠렛을 이용하여 3번 씩 닦아주었다. 그 후 바로 버튼 부착을 시행하였다(Fig. 3).
3) 열순환 과정 및 보관
브라켓 부착이 완료된 시편은 구강 내 환경을 재현하기 위한 열순환을 시행하였다. 열순환은 열순환기(동연기연, Japan)를 이용하여 5℃와 55℃에서 침적시간 30초 조건하에서 500회 실시하였다.
4) 전단 결합 강도의 측정
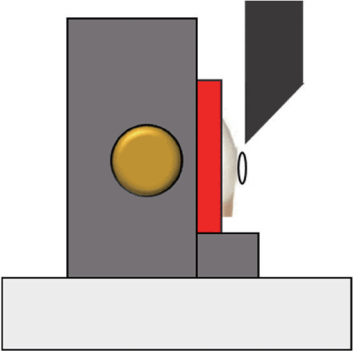
전단 결합 강도는 만능 시험기(Kyung-Sung Testing Machine Co., Korea)를 이용하여 치아 순면과 버튼 부착 계면이 crosshead의 장축과 평행이 되도록 시편을 고정시켰다(Fig. 4). 50 kgF load cell, cross-head speed 1 mm/min 조건하에서 접착이 파절되는 순간의 최고 하중(N)을 측정하였다. 측정된 최고 하중을 브라켓 면적(9.62 mm2 )으로 나누어 MPa (N/mm2 )로 환산하였다.
5) 접착 파절 형태의 관찰
브라켓 접착 계면의 파절 형태를 관찰하기 위하여 접착 파절 후 교정용 브라켓에 남아 있는 접착제를 광학 현미경을 이용하여 10배 배율로 관찰하였다. 접착제가 남아 있는 양상은 Årtun과 Bergland[11]의 접착제 잔류지수(Adhesive Remnant Index, ARI)를 이용하여 수치화하여 기록하였다(Table 3).
5) 주사전자현미경 관찰(scanning electron microscope)
전단 결합 강도 측정 후 교정용 브라켓이 탈락된 치아 시편을 다이아몬드 절단기(RB METSAW, R&B Inc., Korea)를 이용하여 시편 기저면에 수직으로 절단하여 접착면의 두께가 3 mm가 되도록 일정하게 절단하였다. 절단된 시편은 주사전자현미경으로 관찰하기 전까지 멸균된 증류수에 보관하였다. 마그네트론 코팅기(JEOL MSC201, Ted pella, USA)를 이용하여 표면처리를 시행해준 후 주사전자현미경(JSM-6510, JEOL, Japan)을 이용하여 브라켓 탈락 표면을 관찰하였다.
3. 통계 분석
통계 처리는 SPSS Version 17.0 (SPSS Inc., USA)을 사용하여 각 군의 전단 결합 강도의 평균과 표준편차를 산출하였으며, 측정된 전단 결합 강도의 연관정도 및 접착제 잔류 지수의 연관 정도를 알아보기 위해 Kruskal-Wallis test로 유의성 검증 후 Mann-Whitney test로 사후 검정을 시행하였다.
Ⅲ. 연구 성적
1. 전단 결합 강도 측정 결과
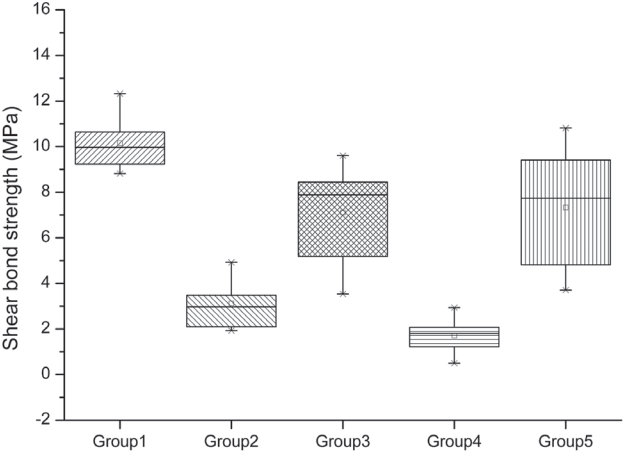
각 군의 평균 전단 결합 강도는 Ⅰ군, Ⅴ군, Ⅲ군, Ⅱ군, 그리고 Ⅳ군 순으로 높은 전단 결합 강도를 나타냈다(Table 4, Fig. 5). 평균 전단 결합 강도의 통계적 유의차는 Ⅰ군과 Ⅴ군 그리고 Ⅲ군과 Ⅴ군 간에 유의차가 없었으며, 나머지 군에는 모두 유의차가 있었다(p < 0.05).
2. 접착 파절 형태
접착 파절의 형태는 Ⅰ군이 가장 높은 수치를 보였으며, 접착제 잔류지수 3점의 빈도가 높았고, 다음으로 Ⅴ군, Ⅲ군 순이었으며 0점 혹은 1점이 관찰되었다. Ⅱ군과 Ⅳ군은 접착제 잔류지수가 모두 0으로 모두 치면에 레진이 남아있지 않았다(Table 5). 통계적 유의차는 대조군(Ⅰ군)과 실험군(Ⅱ군, Ⅲ군, Ⅳ군 그리고 Ⅴ군) 간에만 통계적으로 유의차가 있었다(p < 0.05).
3. 주사 전자 현미경 관찰
각 군의 법랑질 표면 양상 관찰을 위하여 주사 전자 현미경을 이용하여 1000배로 관찰하였다. 접착 파절의 형태는 Ⅰ군에서는 치면에 레진이 남아있으며 매쉬 구조의 거친 표면이 보였으며, Ⅱ군과 Ⅲ군은 type Ⅲ 법랑질 산부식 패턴으로 불명확한 부식 양상을 보이고 Ⅳ군과 Ⅴ군은 typeⅠ 법랑질 산부식 패턴 양상을 보였다. 실험군에서 Ⅱ군과 Ⅳ군이 Ⅲ군과 Ⅴ군에 비해 불규칙한 양상이 관찰되었다(Fig. 6).
Ⅳ. 총괄 및 고찰
교정력을 이용한 맹출 유도는 유효한 결합 강도를 얻을 수 있도록 교정용 브라켓을 치면에 적절하게 부착하는 것이 성공적인 치료 결과를 위해 필요한 요소이다[12]. 임상적으로 성공적인 결합 강도를 얻기 위해 대부분의 접착 술식 과정에서 오염되지 않은 깨끗한 법랑질 표면이 요구된다. 하지만 실제 개창술 시행 시 이상적인 환경에서 부착이 힘들며 혈액 오염이 빈번하게 발생하게 된다. 혈액은 약 80%가 수분으로 이루어져있고, 나머지 18%는 단백질로 혈구 단백질과 혈장 단백질로 구성되어있다. 또한 혈액의 2%는 지방질로 콜레스테롤, lecithin 그리고 무기질 및 질소 화합물이 존재한다[13]. 즉, 이런 혈액의 다양한 구성 성분이 법랑질 치면을 오염시키면서 결합 실패를 야기하는 요인으로 작용하게 된다[6-8,14].
치면 오염이 레진의 결합 강도에 영향을 미친다는 많은 연구가 있는데 Zachrisson[15]은 산부식 후의 수분 오염이 접착 실패의 가장 흔한 이유라고 하였으며, Hormati 등[5]에 의하면 습윤 상태는 전단 결합 강도를 1/2 감소시킨다고 하였다. 타액은 습윤 상태보다 더 복잡하며 Silverstone 등[16]에 의하면 산부식된 법랑질이 타액으로 오염되었을 때 유기물 부착막이 생기며 수세해도 제거되지 않는다고 하였다. 하지만 혈액은 무기물과 유기물의 종류와 양이 타액 보다 더 많아 더 큰 기계적인 장벽이 형성되게 되며 Pashley 등[17]에 의하면 단백질 오염이 전단 결합 강도를 유의하게 감소시킨다고 하였다. 그 외 많은 연구에서 혈액 오염이 되었을 때 유의하게 전단 결합 강도의 감소가 보였다[6-8,18].
출은 하지 않은 매복치는 교합력 등의 외부 저항이 상대적으로 적으므로 교정적 정출술에 필요한 정출력을 견딜 수 있는 상대적으로 크지 않은 전단 결합 강도가 요구된다. 임상적으로 매복치 정출을 시행한 여러 증례에서 30 - 60 g 정도의 교정력을 적용한다고 하였으며 60 g을 넘지 않는다고 보고하였다[19-21]. Reynold 등[22]은 임상에서 유효한 브라켓의 최소 결합 강도는 5.9 - 7.8 MPa이라고 하였고, MacColl 등[23]과 Proffit 등[24]은 임상적으로 요구되는 브라켓의 결합 강도는 약 5 - 15 MPa이라고 하였다. 또한 MaCarth와 Hondrum[25]은 요구되는 최소 전단 결합 강도가 7 MPa 이상이라고 하였다. 종합하여 보았을 때, 최근의 레진 접착제를 사용한 여러 연구에서 6 - 9 MPa 사이의 결합 강도가 적절하다고 하였다[25-28].
본 연구의 목적은 프라이머 도포 후, 광중합 전과 후에 혈액이 오염되었을 때 세척 방법에 따라 전단 결합 강도에 미치는 영향을 평가해보는 것이었다. 본 연구에서 평균 전단 결합 강도는 대조군인 Ⅰ군은 Ⅴ군만 제외하고 다른 모든 군에서 통계적으로 유의하게 높은 전단 결합 강도를 보였다. 이는 혈액 오염이 되었을 때 결합 실패를 야기한다는 것을 의미한다. Hormati 등[5]에 의하면 오염된 법랑질에서 결합 강도가 약해지는 것은 부식된 법랑질 표면의 습윤 상태로 다공질 대부분에 수분 및 오염원이 차게 되어 레진의 침투가 잘 되지 않아 resin tag의 수와 깊이가 불충분하게 형성되기 때문이라고 하였다. 또한 Poulsen 등[29]은 오염된 경우, 세척 후에도 유기물 및 오염물질이 완벽하게 제거되지 않게 되는데 이것은 산부식으로 생긴 기공에 의한 기계적 유지와 노출된 칼슘과 인산 이온이 단백질과 이온 결합을 하기 때문이라고 하였다. 이는 접착제 잔류지수의 결과 값에도 나타나는데 대조군인 Ⅰ군은 치면에 접착 레진이 남아있는 경우가 많았으나 실험군은 치면에 레진이 남아있지 않은 경우가 많았으며, 대조군과 실험군간에 유의차가 있었다(p < 0.05).
실험군에서 평균 전단 결합 강도는 Ⅴ군, Ⅲ군, Ⅱ군 그리고 Ⅳ군 순으로 높았다. 그리고 Ⅲ군과 Ⅴ군 간만 제외하고 통계적으로 유의차가 있었으며, Ⅲ군과 Ⅴ군만 임상적으로 유효한 전단 결합 강도를 만족하였다. 이는 세척 시 코튼 펠렛으로만 닦았을 때보다 수세 후 코튼 펠렛으로 닦았을 때 전단 결합 강도가 더 높았는데 이것은 수세 후 코튼 펠렛으로 닦았을 때 혈액으로 오염된 치면을 더 효과적으로 세척할 수 있다는 것을 의미한다. 이러한 양상은 주사 전자 현미경 사진 상에서도 관찰이 되는데 프라이머 광중합 전과 후 각각에서 코튼 펠렛으로만 닦은 군이 수세 후 코튼 펠렛으로 닦은 군에 비해 산부식 구조가 더 불규칙하였다. 이는 혈액 오염으로 남은 유기물과 무기물에 의해 생긴 도말층 및 불순물으로 규칙적이지 않은 표면이 생긴 것으로 사료된다.
프라이머 광중합 전과 후의 혈액 오염 시 평균 전단 결합 강도를 비교해 보면 수세 후 코튼 펠렛으로 처리한 군의 평균 전단 결합 강도는 Ⅲ군은 7.11 MPa이고 Ⅴ군은 7.33 MPa로 두 군 간에 유의차는 없었다. 또한 코튼 펠렛으로만 처리한 군인 Ⅱ군은 3.23 MPa이고 Ⅳ군이 1.71 MPa로 두 군간에 유의차가 있었으며 광중합 후에 오염된 군이 더 낮은 전단 결합 강도를 보였다. Webster 등[30]의 오염원 적용 시기에 따른 전단 결합 강도의 차이를 비교한 연구에서 산부식 후 프라이머 적용 전에 오염된 군이 프라이머 적용 후에 오염된 군에 비해 유의하게 낮은 결합 강도를 보여 본 연구와 다른 결과를 보였다. 그러나 본 연구에서 프라이머 광중합 전에 오염이 될 경우, 임상적으로 프라이머가 다 제거된다고 간주하여 프라이머를 재적용하여 연구 결과가 다르게 나온 것으로 사료된다. 최 등[31]의 프라이머 재적용에 따른 결합 강도의 차이를 비교한 연구 결과에서 프라이머 재적용은 광중합 전에 오염이 되었을 경우 통계적으로 유의하게 높은 결합 강도를 보였으나 광중합 후 오염이 되었을 때는 유의차를 보이지 않았다고 하였다. 즉, 본 연구에서 Ⅲ군과 Ⅴ군에 유의차를 보이지 않고, Ⅱ군이 Ⅳ군보다 더 높은 전단 결합 강도가 나온 것은 프라이머 광중합 전 혈액 오염 환경에서 프라이머 재도포를 하였기 때문이라고 사료된다.
세척과 건조는 오염원의 제거는 물론 프라이머가 씻겨나가게 되어 프라이머와 레진 간의 중합을 방해하고[3], 완전한 세척이 되지 않을 경우 중합되지 않는 산소 저해층(oxygen inhibited layer)에 단백질을 흡착시키게 된다. 본 연구에서 대조군(Ⅰ군)과 광중합 전후 혈액 오염을 수세 후 건조하였을 때(Ⅲ군, Ⅴ군) 임상적으로 유의한 전단 결합 강도를 보여 혈액 오염 환경에서 수세 후 건조하는 것이 효과적이라는 것을 알 수 있었다.
하지만 전단 결합 강도는 다양한 법랑질 표면 상태, 전단 결합 강도 측정 시 브라켓에 닿는 위치, 재료 등에 의해 오차가 발생하여 다양한 결과가 나올 수 있다. 본 연구는 실험실 환경에서 이루어져 구강 내 환경과 차이가 있을 수 있으며 브라켓 부착 시 치면에 압접시키는 압력이 실제 임상에서 적용하였을 때와 다를 수 있다. 또한 혈액 채취 시 항응고제로 처리한 혈액으로 실험을 진행하였는데 여러 연구에서 항응고제가 전단 결합 강도를 떨어뜨릴 수 있다고 하여 이를 보완하는 추가적인 연구가 필요할 것으로 사료된다[32].
Ⅴ. 결 론
본 연구는 프라이머 광중합 전과 후에 혈액 오염이 되었을 때 세척 방법에 따라 전단 결합 강도에 미치는 영향을 평가해보고, 접착 파절 형태를 확인하고자 하였으며 다음과 같은 결론을 얻을 수 있었다. 평균 전단 결합 강도는 Ⅰ군, Ⅴ군, Ⅲ군, Ⅱ군 그리고 Ⅳ군 순으로 나왔으며 대조군인 Ⅰ군은 Ⅴ군 간만을 제외한 다른 군에서 통계적으로 유의미하게 높은 전단 결합 강도를 보였다(p < 0.05). 그리고 실험군에서 Ⅲ군과 Ⅴ군 간만 제외한 모든 군 간에 유의차가 관찰되었으며 Ⅰ군, Ⅲ군 그리고 Ⅴ군에서 임상적으로 유의한 전단 결합 강도가 관찰되었다(p < 0.05). 또한 주사 전자 현미경 사진 상에서 수세 후 코튼 펠렛으로 닦은 군이 코튼 펠렛으로만 처리한 군에 비해 더 균일한 산부식 표면을 보였다. 접착제 잔류지수는 대조군(Ⅰ군)과 실험군(Ⅱ군, Ⅲ군, Ⅳ군 그리고 Ⅴ군)간에 유의차가 있었으며(p < 0.05) 대조군은 치면에 접착 레진이 남아있는 경우가 많았으나, 실험군에서는 치면에 남아있지 않은 경우가 많았다. 이상의 결과를 종합해 볼 때, 개창술 시술 과정에서 교정용 브라켓 부착 시 혈액 오염이 발생한 경우, 수세 후 코튼 펠렛으로 닦는 방법이 임상적으로 정출력에 유효하게 견딜 수 있는 전단 결합 강도를 나타내었으며, 부착이 용이한 새로운 형태의 버튼이나 혈액 오염에도 잘 견딜 수 있는 접착 레진의 개발이 필요할 것으로 사료되었다.