과잉치 치수 세포의 계대별 석회화 비교
Comparison of Mineralization in Each Passage of Dental Pulp Stem Cells from Supernumerary Tooth
Article information
Abstract
본 연구는 상악 정중과잉치에서 얻은 치수유래 줄기세포(human dental pulp stem cells from supernumerary tooth, sDPSCs)를 대상으로 분화능의 변화 특성을 알아보고자 하였다.
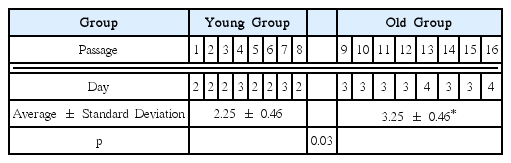
전신 병력이 없는 6세 남자아이 상악 중절치와 측절치 사이에 매복 된 과잉치를 발치하여 sDPSCs를 얻었다. 세포들을 16계대까지 배양하였고, 1 - 8계대는 Young군으로 9 - 16계대는 Old군으로 나누었다. 각 계대 배양에 소요된 시간은 Young군에서는 2.25 ± 0.46일, Old군에서는 3.25 ± 0.46일을 보였으며, 이는 통계적으로 유의한 차이를 보였다(p < 0.05). 각 계대 별로 세포 형태를 관찰하고 분화를 유도한 후 Alizarin-red solution 염색을 통해 골모세포(odontoblast)로 분화되는 정도를 관찰하였다. 1, 8, 9계대에서 분화제를 처리하지 않은 세포의 형태에서는 방추형의 섬유모세포와 유사한 길쭉한 형태로 과립(nodule)이 적었지만, 16계대에서는 세포의 크기가 커지고 넓적한 형태로 변하고 과립도 많아졌다. 1계대는 분화 7일부터 과립이 관찰되며, 8계대에서는 14일 동안 분화제를 처리한 후 과립이 명확히 관찰되었다. 그러나 9계대 이후에서는 과립의 빈도가 상당히 감소되었다. ARS 염색에서는 1, 8계대는 진한 붉은색으로 염색되었으나, 9, 16계대는 염색이 옅게 되었다.
이를 통해 sDPSCs는 8계대 이전의 세포를 줄기세포의 원천으로 우선 고려하는 것이 좋다고 사료된다.
Trans Abstract
The purpose of this study was to evaluate the difference of differentiation potential in each passage of dental pulp stem cells from supernumerary tooth (sDPSCs). The sDPSCs were obtained from a healthy 6-year-old male patient under the guidelines and got the informed consent. Cells were cultured until passage number 16 and divided into two groups; 1 - 8 passages as a young group and 9 - 16 passages as an old group. It was taken 2.25 ± 0.46 days in a young group and 3.25 ± 0.46 days in an old group to propagate cells of each passage until confluence and there were statistically significant differences between two groups (p < 0.05). In every passage, cell morphology was observed with microscope and evaluated the capacity to form high levels of minerals by alizarin red solution staining after treating differentiation medium. Fibroblast-like, spindle shaped, elongated cells and a few nodules were found in uninduced cultures of passage number 1, 8 and 9. But at 16 passage culture, cell size became larger and broader and observed with more nodules. After inducing differentiation, mineralized nodules were detected at the first passage of 7th day culture whereas at the 8 passage culture, nodules were seen clearly at 14th day culture. In addition, the amount of mineralized nodules were remarkably decreased after passage 9. From the data presented in this study, it is recommended to use sDPSCs of passage number within 8 for utilizing as stem cells.
Ⅰ. 서 론
줄기세포는 두 가지 특징적 능력인 자기재생능(self-renewal)과 분화능(differentiation)을 가진다[1]. 조직 재생에 대한 관심이 커지면서 조금은 윤리적인 성체줄기세포 연구에 관한 연구가 증가하고 있다[2-4]. 그 중에서 중간엽줄기세포(mesenchymal stem cell, MSC)는 조직의 재생이 가능하고 이식 후 각 조직의 특성에 맞게 분화가 가능하여 보다 많은 세포를 얻기 위한 연구가 이루어지고 있다[5]. MSC는 주로 골수에서 채취하고 있지만, 공여자의 나이가 많은 경우 줄기세포의 수나 증식 능력이 감소한다[6]. 또한 MSC의 증식과 분화능은 계대가 증가하면서 감소한다[7,8].
줄기세포의 원천(source)으로 사용하기 위해서는 공여자에게 가급적이면 적은 피해를 주어야 한다. 치과 분야에서 MSC를 대체하는 줄기세포 공여부로는 사랑니와 발치 된 유치의 치수조직, 치주인대, 치낭, 그리고 치근낭 등이 있다[9-13].
매복 된 과잉치는 인접 영구치의 맹출 지연, 회전 및 전위, 이개 등의 부정교합 그리고 낭종 형성 등을 야기할 수 있어 어린 나이에 발치하게 된다[14]. 과잉치는 매복 된 상태에서 어린 나이에 발치가 계획되므로 무균상태로 조직을 얻을 수 있어서 치아 줄기세포의 원천으로 연구가 되고 있다[15]. 따라서 각 조직에서 얻은 줄기세포가 가장 왕성한 증식과 분화능을 유지한 세포를 채취할 수 있는 계대를 파악하는 연구가 필요하다.
본 연구는 발치하여 폐기되는 과잉치의 치수조직을 줄기세포 원천으로 활용하기 위해 필요한 기초 연구로서 계대배양을 시행하여 각 계대에서 소요되는 시간과 계대 간 분화 정도의 차이를 알아보고자 시행하였다.
II. 연구 대상 및 방법
1. 과잉치 발치 및 치수세포의 채취
전신질환이 없는 만 6세남아의 상악 정중 매복 과잉치를 발치하여 오염과 감염이 되지 않도록 즉시 항생제와 소혈청 20%를 함유한 α-MEM media (GIBCO LifeTechnologies, Grand Island, NY, USA)에 보관하였다. 당일 치수 세포 채취를 위해 실험실로 옮겼고, 백악법랑경계(cementoenamel junction, CEJ) 부분에서 치수가 노출되지 않도록 치질만 삭제한 후 멸균된 파일을 이용하여 치수세포를 채취하였다.
2. 과잉치 치수유래 줄기세포 (dental pulp stem cells from supernumerary tooth, sDPSCs) 분리 및 배양
과잉치 치수로부터 얻은 줄기세포는 과잉치 치수유래 줄기세포 (supernumerary dental pulp stem cells, sDPSCs)라고 명명하였다. 멸균된 공간에서 추출한 치수세포를 자른 후 3 mg/mL의 Type I collagenase (Sigma-Aldrich Co., St. Louis, MO, USA) 와 4 mg/mL 의 Dispase (Sigma-Aldrich Co., St. Louis, MO, USA)를 넣고 37℃, Shaking incubator에 1시간 동안 두어 세포가 분리 되도록 하였다. 이후 Single cell을 얻기 위해 70 μm Falcon strainer로 거른 후에 필터를 빠져 나온 세포를 37℃의 항온기에서 7일간 배양하였다. 배지는 48시간 후부터 교체하기 시작하여 2 - 3일에 한번씩 바꾸었다. 배양용기 바닥에 부착되지 않는 부유물들은 배지 교체 시 함께 제거되었다. 바닥에 부착된 세포가 80% confluence에 도달하면 Trysin-EDTA (CORNING Inc, NY, USA)로 세포를 분리시킨 후 1/4씩 나누어 동일한 방법으로 16계대까지 배양하며 각 계대 사이에 소요된 날짜를 기록하였다. 16계대까지 배양하는 동안 계대 배양 시간을 비교하기 위해 비교적 젊은 세포 군을 8계대까지로 설정하고 1 - 8계대까지를 Young Group, 9 - 16계대까지를 Old Group으로 나누었다.
3. 골분화 유도 후 세포형태 관찰
줄기세포의 분화능을 알아보기 위해 골분화를 유도하였다. 각 계대에서 줄기세포의 골모세포로의 분화유도를 평가하기 위해 sDPSCs를 분화제를 처리하지 않은 군과 분화제를 처리한 군으로 나누어 배양하였다. 골분화를 유도하기 위해, α-MEM (Gibco, LifeTechnologies, Grand Island, NY, USA)에 10% fetal bovine serum (FBS; Gibco, Life Technologies Corporation, Carlsbad, Calif, USA)에 5mM β-glycerophosphate (Sigma-Aldrich Co., St. Louis, MO, USA), 100 nM Dexamethasone (Sigma-Aldrich Co., St. Louis, MO, USA) 그리고 100 μM Ascorbic acid (Sigma-Aldrich Co., St. Louis, MO, USA) 를 혼합하여 제작한 골분화 배지에서 배양하였다. 배양액은 3일에 1회씩 교환해주며 20배 광학현미경 하에서 세포의 형태학적 특성을 7일, 14일 두 번 관찰하였다.
4. Alizarin-red solution 염색
분화 여부를 시각적으로 확인하기 위해 Alizarin-red solution (ARS, pH 4.5) 염색을 시행하였다. 이를 통해 세포 밖에 형성된 석회화 결절을 시각적으로 비교하였다. 세포를 70% 에탄올에 5분간 고정하고 2% Alizarin-red solution (Sigma-Aldrich Co., St. Louis, MO, USA)으로 5분간 염색한 다음 증류수로 세척한 후 건조하였다. 골분화 유도제를 적용한 군은 14일간 분화 시킨 후 염색하였다.
5. 통계 분석
SPSS 23 (SPSS, Chicago, IL, USA)과 Excel 2007 (Microsoft Inc., Chicago, USA)을 이용하여 분석하였다. 군 간 유의성 차이를 비교하기 위하여 Mann-Whitney test를 이용하였다. 통계 분석의 유의수준은 p< 0.05로 하였다.
III. 연구 성적
1. 계대 배양에 소요된 시간
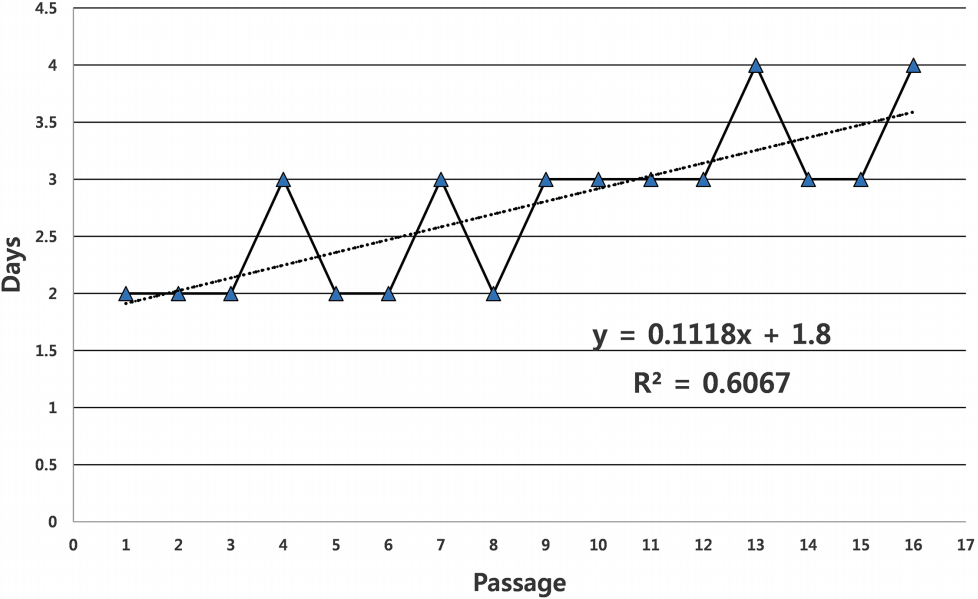
80% confluence를 이루어 다음 계대로 넘어가는데 소요된 날짜를 Fig. 1에 나타내었다.
그래프를 회귀 분석한 결과 R2 값은 0.6067로 높은 상관관계를 보이며 계대가 지속될수록 시간이 증가하였다. 9계대 이후인 Old군에서는 계대를 넘어가는데 시간이 다소 증가하였다.
Table 1에서 9계대 이후인 Old군에서 계대 간 평균 소요 시간이 3.25 ± 0.46으로 8계대까지인 Young군의 2.25 ± 0.46보다 통계적으로 유의한 차이를 보였다(p< 0.05).
2. 골분화 유도 후 세포형태 관찰
광학현미경 하에서 분화제를 적용하지 않은 군은 Young군에서는 1, 8계대를 Old군에서는 9, 16계대의 세포를 관찰하였다. 분화제를 적용한 후 7일, 14일째에서 분화제를 적용하지 않은 군과 동일하게 1, 8, 9, 그리고 16계대의 세포의 형태를 관찰하였다(Fig. 2).

A: The morphology of pulp cells cultured without any differentiation additives at 1 passage. B: The morphology of pulp cells cultured with additives for differentiation for 7 days at 1 passage. C: The morphology of pulp cells cultured with additives for differentiation for 14 days at 1 passage. P1: 1 passage, P8: 8 passage, P9: 9 passage, P16: 16 passage. Scale bar: 100 μm. 20×
1, 8, 9계대에서 분화제를 처리하지 않은 세포의 형태에서는 방추형의 섬유모세포와 유사한 길쭉한 형태로 과립이 적었지만, 16계대에서는 세포의 크기가 커지고 넓적한 형태로 변하고 과립(nodule)도 많아졌다.
1계대는 분화 7일부터 과립이 관찰 되며, 8계대에서는 14일 동안 분화제를 처리한 후 과립이 명확히 관찰 되었다. 그러나, 9계대 이후에서는 과립의 빈도가 상당히 감소되었다.
3. Alizarin-red Solution염색 관찰
분화제를 처리하지 않은 군에서는 모든 계대에서 비슷한 양상으로 약하게 염색되는 소견을 보였다. 반면, 14일 동안 분화제를 처리한 군에서는 Young군인 1, 8계대에서 Old군인 9, 16계대 보다 육안으로 구분될 만큼 진하게 염색되었다(Fig. 3).
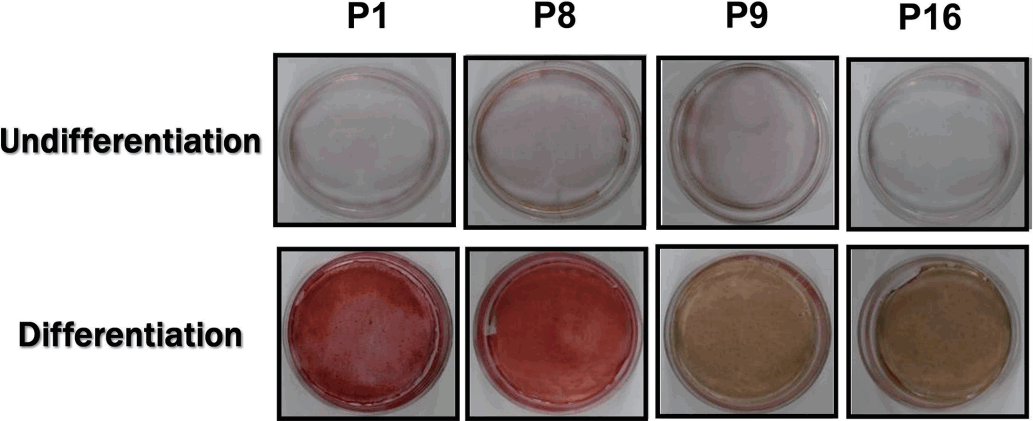
The alizarin-red solution staining images of undifferentiation groups. The staining was not definitive through all passages. The alizarin-red solution staining images of differentiation groups that was cultured with additives for 14 days. In early passages, passage numbers 1-8 were highly mineralized by performing the alizarin-red solution staining. However, over passage number 9, mineralization of cell was rapidly decreased.
IV. 총괄 및 고찰
본 연구의 목적은 성체줄기세포의 원천으로 과잉치의 가능성을 알아보는 것이었다. 좀 더 효율적으로 세포를 확보할 수 있는 계대를 알아보고자 1 - 8계대까지를 Young군으로 9 - 16계대를 Old군으로 나누어 계대 배양에 필요한 시간과 분화제 처리 전후를 Alizarin-red염색법을 통해 비교하였다.
Hayflick[16]이 세포가 50 - 70여 차례 분열한 후에는 더 이상 분열하지 않고 죽는다고 보고한 이후, Hayflick limit은 세포 연구의 한계로 남아있었다.
그는 또한 채취한 섬유모세포가 채취 당시의 나이와 연관이 있어서 어릴 수록 좀 더 많이 분열할 수 있다고 하였다[16]. 이후 많은 연구들이 Hayflick limit이 모든 세포에 적용되는 것이 아니라는 사실을 발견하였다[17]. Evans 등[2]이 쥐의 배아줄기세포를 확립하는데 성공한 후, 줄기세포의 무한한 자기재생능(self-renewal)과 모든 세포로 분화가 가능한 전능성에 대한 연구가 본격적으로 진행되었다.
줄기세포는 기원에 따라 배아줄기 세포, 성체줄기 세포로 나눌 수 있다[18]. 성체줄기세포는 신체 각 조직에서 존재하는 미분화 된 세포이며 골수, 제대혈, 골막, 췌장, 지방, 근육, 혈액, 모낭, 피부, 그리고 치아조직 등의 다양한 조직에서 얻을 수 있다[2-4].
MSC는 반복적인 계대 배양에 의해 증식률이 감소하고 형태적 변화가 관찰되고[19], 노화에 관련된 인자들의 발현도 증가한다[20,21]. MSC를 특정하기 위한 조건은 일반적인 배양조건에서 배양판에 부착되어 배양되며, 특정한 세포표면 표지자(cell surface marker, CD marker)의 발현이 관찰되고, 마지막으로 MSC를 특정 분화조건을 가진 배지상에서 분화 시키면 골세포, 지방세포, 연골세포 등으로 성공적인 분화가 일어난다는 점이다[22,23].
치아줄기세포(dental stem cells, DSC)는 성인이 된 이후에도 미분화 조직이 남아있어 비교적 원시적인 줄기세포 추출이 가능하다[24,25]. 주된 연구 대상인 제3대구치는 발치 시기가 다양하고 비교적 성인이 된 후에 발치 하게 되므로 추출한 DSC가 유치나 과잉치 유래 세포보다 분화능이 낮다고 보고되었다[6,24,26]. 또한 유치유래 줄기세포는 완전한 dentin-pulp-like complex를 형성할 수 없었다[13]. 탈락하는 유치[10,13]나 제3대구치[11], 과잉치[27] 등의 치수에도 치아줄기세포가 존재한다.
치수유래 줄기세포(dental pulp stem cells, DPSCs)는 25계대 이상 증식이 가능하고 면역조절능을 가지고 있다[24,28,29]. 이를 참고하여, 본 연구는 6세 남아로부터 발치 한 과잉치를 이용하여 16계대까지 배양하면서 1- 8계대까지를 Young군, 9 - 16계대까지를 Old군으로 나누어 두 군간 계대 배양에 소요되는 시간을 비교하였다. 그리고 분화제를 처리하지 않은 군과 분화제를 처리한 군으로 나누고 ARS염색 정도를 비교하였다. 이를 통해 향후 진행할 연구에서 효율적인 치아줄기세포를 얻을 수 있는 계대에 대해 알아보고자 하였다.
계대 배양에 소요된 시간은 Old군에서 증가하기 시작하였다. Young군 2.25 ± 0.46일인 반면 Old군은 3.25 ± 0.46일로 통계적으로 유의한 차이가 있었다(p< 0.05). 회귀분석에서 계대에 따른 배양 시간의 R2 값도 0.61로 높은 상관관계를 보였다. 이전 연구에서 MSC가 골모세포로 분화하는 동안 세포의 증식력이 감소한다는 것과 일치하는 결과를 보였다[19,30,31]. 이러한 결과는 제3대구치를 이용한 연구에서 소요된 시간인 7 - 10일 보다 상당히 짧았다[32]. 탯줄 유래 줄기세포를 이용하여 계대 배양 후 증식 능력을 본 연구에서 7계대 이후에 증식능력이 감소하였다는 연구에 비춰봐도[33] sDPSCs가 보다 젊고 왕성한 분화능을 가진 것이라 추측할 수 있다.
16계대를 진행하는 동안 sDPSCs의 형태적 변화를 살펴본 결과 미분화군에서 초기에는 방추형의 섬유모세포와 유사한 길쭉한 형태로 과립이 적었지만, 16계대에서는 세포의 크기가 커지고 넓적한 형태로 변하고 과립도 많아졌다. 분화제를 처리한 경우, 1계대는 분화 7일부터 과립(nodule)이 관찰 되며, 8계대에서는 14일동안 분화제를 처리한 경우 과립이 명확히 관찰되었다. 그러나, 9계대 이후에서는 분화제의 처리 기간과 관계없이 과립의 빈도가 상당히 감소되었다. 이는 기존에 연구에서 계대가 증가할수록 형태 변화와 함께 분화 잠재력이 감소한다는 연구와 일치한 결과이다[8,34].
sDPSCs의 분화에서 형성된 석회화 과립 정도를 알아보기 위해 ARS 염색을 시행하였다. ARS는 Ca2+와 결합해 붉은 색을 띄는 복합체를 만들어 육안으로 관찰하기 용의하다. 분화제를 처리하지 않은 경우, 모든 계대에서 염색이 되지 않았다. 분화제를 처리한 경우, 8계대까지 붉게 염색되었지만 Old군이라 설정한 9계대 이후에서는 염색 정도가 확연히 감소하였다. 이는 계대 배양에 따른 MSC의 골모세포로의 분화에서 칼슘 침착량이 감소한다는 연구와 일치하는 결과였다[8,35]. 그러나 계대 배양에 따른 MSC의 분화능은 골모세포로의 분화에는 영향이 없고 지방세포로의 분화에만 영향을 미친다고 주장한 것과는 배치되는 결과이다[8,36].
계대가 증가 함에 따른 유전자 변형 및 telomere의 활성 감소 등을 확인하기 위한 추가적 연구가 필요할 것으로 판단되며, sDPSCs는 8계대 이전의 세포를 활용하는 것이 좋을 것으로 사료되었다.
V. 결 론
본 연구에서 sDPSCs를 1 - 8계대까지는 Young군으로 정하고 9 - 16계대까지는 Old군으로 하여 각 계대 별 소요 시간과 분화제를 처리하여 ARS 염색법을 통해 골모세포로 분화 정도를 알아보았다.
Young군에서는 2.25 ± 0.46일, Old군에서는 3.25 ± 0.46일을 보였으며 이는 통계적으로 유의한 차이를 보였다(p< 0.05). ARS 염색에서는 분화제 처리 후 Young군과 Old군 사이에 염색 정도가 확연한 차이를 보였다.
이를 통해 sDPSCs는 빠른 계대 배양 시간과 자기재생능을 보인 8계대 이전의 세포를 줄기세포의 원천으로 활용하는 것이 좋을 것이라고 사료되었다.