성견 치아의 치수절제술 후 3가지 근관충전재에 따른 조직학적 반응의 비교
Comparative Histologic Study of 3-Root Canal Filling Materials for Dog’s Teeth
Article information
Abstract
이 연구의 목적은 치수절제술을 시행한 개의 치아에서 서로 다른 수산화칼슘계 근관충전재인 Vitapex®, Metapex®, 그리고 Metapaste®의 적용 기간에 따른 치근단 조직의 조직학적 반응을 비교한 것이다.
12마리의 비글 성견을 연구 대상으로 하였으며 총 132개의 치아를 사용하였다. 각 치아의 근관에 충전될 재료는 Vitapex®, Metapex®, 그리고 Metapaste® 중 무작위로 배정하여 재료 당 44개의 치아가 선택되었다.
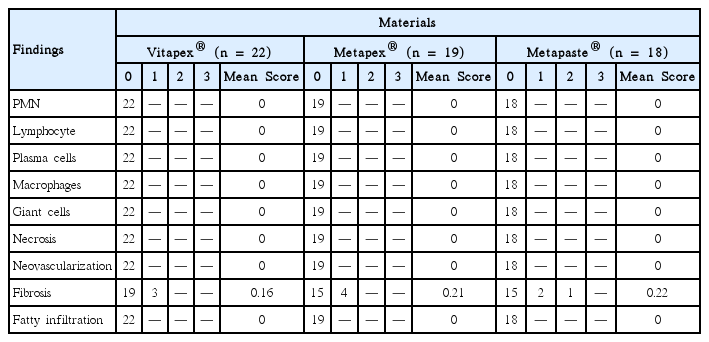
4주 적용 후 섬유화를 제외한 다른 반응 지표는 모두 0점을 기록하였다. 세 재료 모두 치근단 조직의 섬유화가 나타난 시편이 있었으나 통계적으로 유의한 차이는 아니었다.
13주군에서는 4주군에서 보이지 않았던 다형핵백혈구, 림프구, 대식세포, 신생혈관화가 관찰되었고 치근단 조직의 염증세포 침투, 울혈 및 부종이 나타났으나 중등도 이상의 염증 반응을 나타낸 시편은 없었다. 13주군 결과에서 다른 두 재료에 비해 Metapaste®군의 염증 반응 빈도와 정도가 증가하였으나 통계적으로 유의한 차이는 보이지 않았다.
이번 연구에서는 세 종류의 근관충전재가 근관 적용 후 조직학적으로 유사한 결과를 보였다. 더 장기적인 예후 관찰 및 감염 모델에서의 추가적인 연구가 필요할 것으로 판단된다.
Trans Abstract
Endodontic treatment of primary molars is a great challenge to the dentists because of their complex morphology. However, there have been limited controlled in vivo studies about filling materials for primary teeth. Hence, the aim of this study is to evaluate and compare histologic responses of different calcium hydroxide canal filling materials that are used in daily clinical practice.
Pulpectomies were performed in 132 teeth of the dogs. The root canals were randomly filled with either Vitapex® (n = 44), Metapex® (n = 44), or Metapaste® (n = 44). After 4 or 13 weeks, respectively after operation, the dogs were sacrificed, and teeth were processed for histologic examinations. Inflammatory reaction was evaluated and scored in a blind manner. The Fisher’s exact test and Kruskal-Wallis test were used to compare the tested groups.
In 4-week-group, all inflammatory responses were in normal range except for fibrosis. In 13-week-group, increased response to various inflammation reaction was shown compared to the 4-week-group. However, there were no statically significant differences between the tested groups in all inflammatory reaction.
Overall, there were no significant differences among three materials in responses of apical tissues and all of them showed favorable tissue responses.
Ⅰ. 서 론
치수절제술은 기계적인 괴사조직의 제거 및 항균 물질을 이용한 근관 내부의 세척, 그리고 근관 충전을 통해 이루어진다[1]. 삼차원적인 근관의 폐쇄는 치관부 및 근단부 밀폐를 통하여 잔존 미생물을 밀봉하여, 근관의 재감염 방지를 목표로 한다[2]. 치수 괴사가 일어난 치아의 근관 치료 시, 잔존 세균은 환자의 재내원 전까지 근관계 내에서 다시 증식할 수 있으며, 근관 내 첩약제의 사용을 통해 이러한 재발을 방지할 수 있다[3].
수산화칼슘(calcium hydroxide)은 우수한 항균 능력과 경조직 형성능으로 유치에서 가장 널리 이용되는 근관 내 첩약제이다. 항균 효과는 수산화칼슘의 수산화 이온에 의한 세균의 세포막, 유전물질, 단백질 손상의 결과이며[4,5], 높은 pH는 alkaline phosphatase의 활성을 높이고, 파골 세포가 생산하는 산성 물질을 중화시켜 경조직 분해를 저해한다고 보고되었다[6,7]. 임상적으로 다양한 용도로 사용되는 수산화칼슘 제제는 그 사용범위와 빈도가 증가함에 따라 다른 물질과의 혼합을 통한 여러 연구가 진행되었다[8].
임상에서 사용되는 수산화칼슘은 다음과 같이 세 가지의 성상으로 분류할 수 있다. 첫째는 수용성으로 수산화칼슘을 증류수나 생리식염수와 혼합하여 적용하는 방법이며, 두 번째는 글리세린, 폴리에틸렌글리콜 및 폴리프로필렌 글리콜과 같은 수용성 점성물질과의 혼합 제제, 마지막으로 실리콘 오일, 유지놀 등과 혼합한 지용성 제제가 있다[9]. 국내에서는 수산화칼슘, 요오드포름(iodoform) 및 실리콘 오일을 혼합하여 시린지 형태로 제작한 Vitapex® (Neo Dental Chemical Products Co., Ltd., Japan)와 Metapex® (Meta Biomed Co., Ltd., Korea)가 적용이 편리하여 유치의 근관충전에 널리 사용되고 있다[10-12]. 요오드포름은 비자극성이고 살균 작용이 있으며 방사선 불투과성인 성질 덕분에 수산화칼슘과 혼합하여 근관충전재로 사용되는 물질이다[13]. 특히 재료에 흡수성이 있어 유치의 치수치료에 적합하며 수산화칼슘과 혼합 시 우수한 임상 결과를 보였다[14]. 어린이의 우식에 이환된 유치를 대상으로 한 임상 연구에서 Metapex®는 90 - 100%, Vitapex®는 89 - 100%의 우수한 성공률이 보고되었다[15-19]. 그러나 두 제품의 성분이 유사함에도 불구하고 둘을 함께 비교한 임상 연구는 없었다.
점성이 있는 수용성 수산화칼슘 제제로는 Metapaste® (Meta Biomed Co.)가 시판되고 있다. 점액성 제제는 물에 잘 녹으나 칼슘과 수산화 이온이 서서히 유리되며 수용성 제품보다 조직액에 대한 용해도가 낮은 특성이 있다[20]. Metapaste®는 황산 바륨, 수산화칼슘 및 프로필렌글리콜의 혼합 제제로 미성숙 영구치의 치근단형성술, 치근 외흡수의 치료, 또는 지속적 삼출물이 있을 경우의 임시 충전재로 사용된다. 그러나 Metapaste® 적용 시 치근단 변화에 대한 연구나 임상적 성공에 대한 연구는 드물었다. 따라서 Metapaste®를 근관에 적용 시 조직학적인 변화를 알아보고, 특히 지용성 제제와 비교 시 재료적 특성에 따른 치근단 조직 반응의 차이를 알아보고자 하였다.
이전의 연구들은 대부분 우식이 있는 치아를 대상으로 한 임상연구였으며 임상적 반응과 방사선학적 변화를 관찰하여 성공률을 비교하였다. 그러나 임상 연구의 경우 개체에 따른 특이성을 배제할 수 없는 한계가 있고, ‘임상적 성공’에 대한 기준이 연구마다 상이하여 객관적인 비교가 어려운 단점이 있다. 따라서 이번 연구의 목적은 같은 조건에서 시행한 개의 치수절제술 모델에서 세가지 수산화칼슘 근관충전재에 따른 치근단 조직의 조직학적 반응을 비교하고, 근관 내 적용 기간에 따른 조직학적 반응의 변화를 평가하는 것이었다.
Ⅱ. 연구 재료 및 방법
이 연구는 연세대학교 동물실험부 윤리위원회의 승인을 받아 진행하였다(승인번호 2017-0085). 모든 연구 과정은 국제규격인 ISO 7405[21]에 의한 치과 의료기기의 특성을 고려한 생물학적 안정성 평가 프로토콜을 준수하여 진행하였다.
1. 연구대상
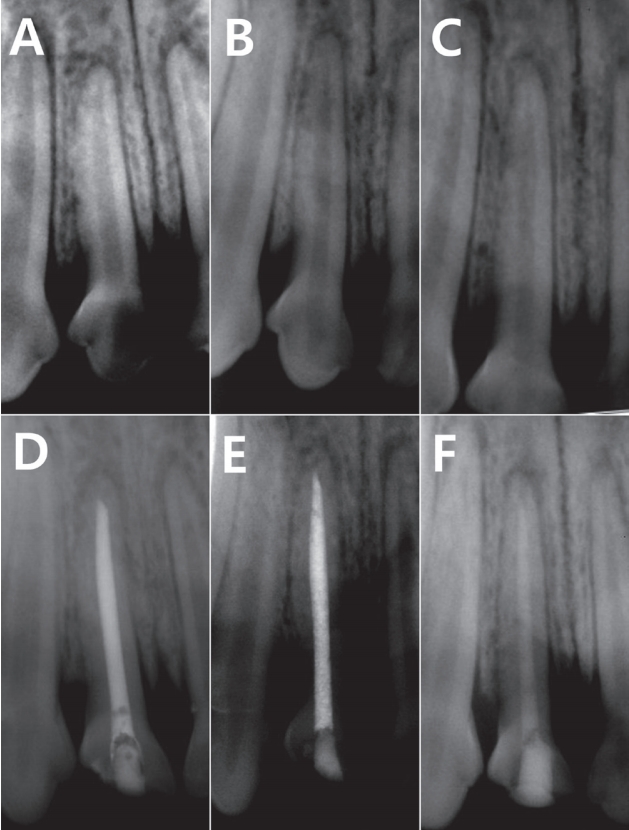
생후 6개월, 체중 10 - 12 kg의 수컷 비글 성견 12마리를 연구대상으로 선별하였으며 한 마리당 11개, 총 132개의 치아를 대상으로 하였다. 치아는 치근단이 완성된 전치 및 소구치를 사용하였으며 인접치아에 대한 영향을 최소화하기 위하여 인접한 치아는 배제하고 다음 치아로 배정하였다. 각 치아의 근관에 충전될 재료는 Vitapex®, Metapex®, 그리고 Metapaste® 중 무작위로 배정하여 재료 당 44개의 치아가 선택되었다. 임상 및 방사선학적 검사를 시행하여 치아 및 치근단의 상태가 양호함을 확인하였다(Fig. 1).
2. 연구재료
본 연구에서는 Vitapex®, Metapex®, 그리고 Metapaste®를 실험군으로 사용하였다(Table 1). 약제 적용 후 상방의 와동은 글라스아이오노머 시멘트 충전재인 Ketac Molar® (3M EPSE, Seefeld, Germany)를 이용하여 수복하였다.
3. 연구방법
럼푼(5 mg/kg, IM)과 졸레틸(15 mg/kg, SC)을 주사하여 실험 동물의 전신마취를 유도한 후 기관 삽관을 통해 1.5 - 2.0% isoflurane으로 호흡마취를 시행하였다. 2% lidocaine으로 국소마취를 한 후 과산화수소수를 이용하여 구강 내를 세척하고 러버댐으로 치아를 격리시켰다. 330번 고속 치과용 버로 치수강을 개방하여 barbed broach로 발수하고 과산화수소수와 생리식염수를 사용하여 근관을 세척하였다. 멸균된 paper point를 이용하여 근관 내를 건조하고 깨끗한 근관 상태를 확인하였다. 치아는 사용된 재료에 따라 Vitapex®군, Metapex®군 및 Metapaste®군으로 분류하였으며, 제조사의 지시대로 각 치아의 근관에 충전하였다. 근관 충전이 끝난 치아는 치근단 방사선 촬영을 시행하여 근관 충전 상태를 확인 후 상방의 와동을 글라스아이오노머 시멘트로 충전하였다. 실험 동물의 상태를 담당 수의사를 통해 주기적으로 확인하였다.
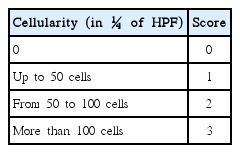
근관 충전 후 4주 및 13주 간격으로 각 6마리의 동물을 희생하였으며, 희생시키기 전에 치근단방사선 사진을 통해 치근단 주위 조직의 방사선 투과성 병소 여부를 확인하였다. 각 치아 마다 주변 악골을 포함하도록 절단하여 10% 포르말린 용액에 2주간 고정하고 Calci-Clear Rapid 용액(National Diagnostics, Atlanta, Georgia, USA)으로 3주간 탈회하였다. 탈회된 조직을 파라핀에 포매하여 경화시킨 후 조직절편을 제작하고, Hematoxylin-Eosin (H-E) 염색을 한 후 광학현미경으로 병리조직학적 평가를 실시하였다. 병리조직학적 평가는 식품의약품안전처에서 고시한 의료기기의 생물학적 안전에 관한 공통 기준 및 시험방법 제 9장[22]과 국제규격인 ISO 7405[21]에 따른 기준을 사용하였다. 염증관련지표는 다형핵백혈구(polymorphonuclear leukocyte, PMN), 림프구(lymphocyte), 플라즈마 세포(plasma cell), 대식세포(macrophage), 거대 세포(giant cell), 세포의 괴사(necrosis), 신생 혈관화(neovascularization), 섬유화(fibrosis), 지방세포의 침투(fatty infiltration)를 평가하였고 기준을 Table 2에 제시하였다. 조직반응 정도는 상피의 변화(epithelial changes), 염증 세포 침투(inflammatory cell infiltration), 혈관 울혈(congestion) 및 부종(edema)의 정도를 평가하고 기록하였다(Table 3).
집단 간 치근단 염증 반응의 유무는 Fisher’s exact test로 비교분석 하였다. 조직반응의 정도를 분석 시에는 독립된 세 군 이상의 비교를 위한 비모수검정 방법인 Kruskal-Wallis test를 시행하였다. 통계분석은 SAS version 9.4 (SAS institute Inc., Cary, NC, USA)을 이용하였다.
Ⅲ. 연구 성적
연구에 사용된 132개의 치아 중 13개의 치아에서 연구 기간 중 치관부 수복물의 파절 또는 조직 처리과정 중 오류가 나타나 해당 치아들은 결과에서 제외하였다. 연구 결과에 포함된 치아들의 분포는 Table 4에 정리하였다. 광학현미경으로 Table 2과 3에 제시된 기준에 따라 각 치아들의 조직학적 반응의 정도를 기록하였다.
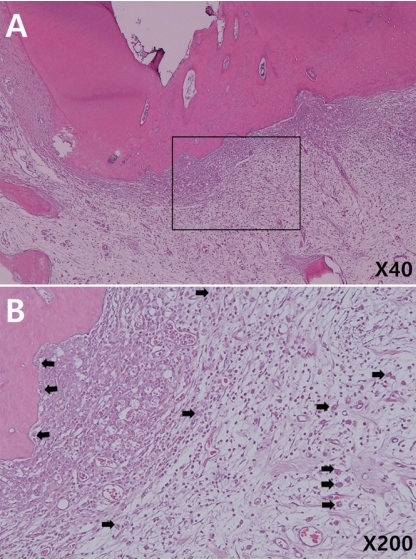
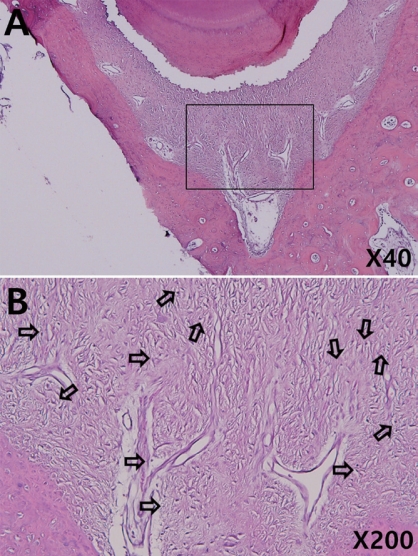
4주군 연구 결과에서 염증 반응을 나타낸 치아의 수 및 정도를 Table 5에 정리하였다. 섬유화를 제외한 다른 염증 반응 지표는 모두 0점을 기록하였고 방사선 촬영 결과 모든 치아의 치근단 주위 조직은 정상범주였다. 정상 조직 변화를 보인 시편의 대표적인 조직 사진을 Fig. 2에 제시하였다. 섬유화가 나타난 치아의 수는 Vitapex®와 Metapaste®군에서 각 3개, Metapex®군에서 4개를 기록하였다(Fig. 3). Metapaste®군에서 유일하게 score 2 수준의 섬유화를 기록한 시편이 있었으나 세 군 간 통계적으로 유의한 차이는 없었다(Kruskal-Wallis test, p= 0.82; Fisher’s exact test, p= 0.91). 4주군 시편 중 치근단 조직 상피의 변화, 염증 세포 침투, 울혈 및 부종을 나타낸 치아는 없었다.

Normal tissue response to each filling material. The periodontal ligament is free of inflammatory cells. There were no specific change between 4-week-group (A, B, C) and 13-week-group (D, E, F). (A, D) Vitapex®, (B, E) Metapex®, (C, F) Metapaste®. (Hematoxylin and eosin; original magnification ×40)
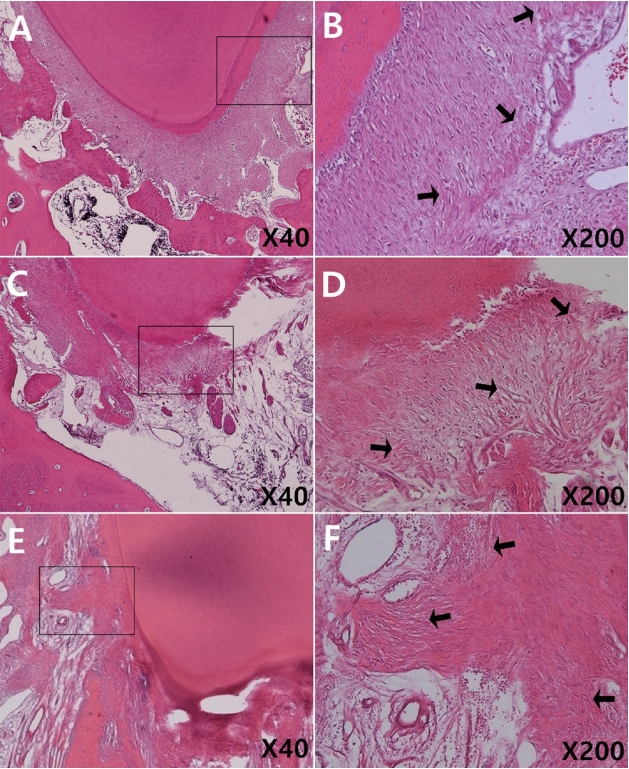
Fibrosis of periapical tissue in 4-week-specimens (Hematoxylin and eosin). Note the fibrotic changes in surrounding tissue (arrows). (B), (D), (F) is higher magnification (×200) of rectangle in (A), (C), (E) respectively (×40). (A, D) Vitapex®, (B, E) Metapex®, (C, F) Metapaste®.
13주군에서는 4주군 보다 다양한 조직반응이 관찰되었다(Table 6, 7). 4주군에서 관찰되지 않았던 림프구, 대식세포, 신생혈관화가 관찰되었다. 특히 4주군과 달리 조직 반응에서 세 재료 모두 염증 세포의 침투가 진행된 시편이 있었고, Metapaste®군에서 다른 군에서 관찰되지 않은 혈관 울혈과 PMN의 출현이 관찰되었다. 각 실험군에서 score 2 수준의 염증 반응을 보인 대표적인 조직 사진을 Fig. 4, 5, 6에 제시하였다. 중등도(score 3) 이상의 염증 반응을 기록한 시편은 없었으며 모든 항목에서 Fisher’s exact test와 Kruskal-Wallis test 결과 세 군 간 유의한 차이는 없었다(p > 0.05). 모든 항목에서 정상적인 조직 반응을 보인 치아의 H-E 염색 결과는 4주군의 조직 사진과 비교 시 특기할만한 차이를 보이지 않았다(Fig. 2).
(A) Inflammatory change of periapical tissue in a 13-week-Vitapex® specimen (Hematoxylin and eosin; original magnification ×40). (B) Higher magnification of rectangle in A (×200). Macrophages (closed arrows) are seen along with other inflammatory cells.
(A) In flamma to r y change of periapical tissue in a 13-week-Metapex® specimen (Hematoxylin and eosin; original magnification ×40). (B) Higher magnification of rectangle in A (×200). Lymphocytes (open arrows) are seen in extended tissue.
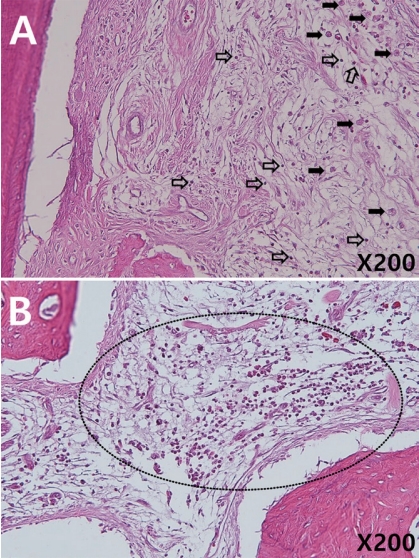
(A) Inflammatory reaction in a 13-week-Metapaste® specimen. Acute and chronic inflammatory cells are present (closed arrows: macrophage, open arrows: lymphocyte). (B) There is a layer of inflammatory cells, mostly polymorphonuclear leukocyte (circle). (Hematoxylin and eosin; original magnification ×200.)
Ⅳ. 총괄 및 고찰
이 연구는 동물 모델에서 서로 다른 수산화칼슘 제제인 Vitapex®, Metapex®, Metapaste® 적용 후 치근단 조직의 병리학적인 차이를 비교했으며, 4주 및 13주 관찰 시 세 재료 모두 조직학적으로 양호한 결과를 얻었다. 염증 반응을 나타낸 시편들은 대부분 최소의 반응 수준(score 1)을 보였고, 중등도(score 3) 이상의 반응을 보인 시편은 없었다. 이와 같은 결과는 수산화칼슘 근관충전재의 우수한 성공률을 보고한 이전의 연구들과 상응하는 결과였다[15-19]. Subramaniam과 Gilhotra[15]는 5 - 9세 소아의 유구치를 대상으로 근관 충전 후 18개월 경과 관찰 결과 Metapex®의 저충전 또는 과충전 여부와 상관 없이 100%의 성공률을 보고했다. 치근단 염증이 있는 유구치를 대상으로 한 임상연구에서는 Metapex®를 사용하여 치수치료를 한 유구치의 9개월 추적검사 결과 약 85%의 성공률을 나타냈다[19]. Vitapex®도 89 - 100%의 임상적 성공률이 알려져 있으며[16], 치근단 염증을 동반한 치아의 치수치료에서 성공적인 사례들이 많이 보고되었다[17,18,23]. Metapaste®의 경우 치근단형성술에 사용 시 100%의 성공률을 보인 임상연구가 있었으나[24], 이 연구 외에는 단독으로 사용한 연구가 드물었다
수산화칼슘은 염기성 환경을 제공함으로써 세균의 활성을 감소시키고 세포막을 변성 시켜 항균 작용을 일으킨다[4]. 수산화칼슘이 파골 세포의 분화 및 활성을 직접적으로 억제하여 경조직 흡수를 억제한다는 연구 결과도 있다[6,7]. 임상에서 근관 내 적용되는 수산화칼슘은 다음과 같이 세 가지의 성상으로 분류된다. 먼저 수용성 제제는 물에 잘 녹고 칼슘과 수산화 이온이 빨리 유리되며 조직에 접촉 시 빠르게 용해가 된다. 다음으로 점액성 제제 물에 잘 녹으나 칼슘과 수산화 이온이 서서히 유리되며 대표적으로 Metapaste®가 시판되고 있다. 마지막으로 지용성 용매를 포함하는 Metapex®와 Vitapex®는 물에 녹지 않고 가장 낮은 조직 용해도를 갖는다[9,20].
Vitapex®와 Metapex®는 임상적으로 증명된 우수한 성공률과 사용의 용이성 덕분에 유치의 치수절제술 및 미성숙 영구치의 치근단 형성술에 널리 쓰이고 있다[10-12]. 그러나 근관 내 완전한 제거가 어렵다는 단점이 있다[25]. 이러한 단점을 보완한 것이 폴리프로필렌 글리콜을 용매로 한 Metapaste®이다. Simon 등[26]은 폴리프로필렌 글리콜이 장기간 수산화칼슘의 유리를 유지하며 적절한 점도를 갖고 있어 수산화칼슘 제제 중 가장 뛰어나다고 보고하였다. 그러나 이번 연구의 결과 Metapaste®군에서는 13주 적용 시 Vitapex®나 Metapex® 시편에서 관찰되지 않았던 PMN과 조직의 울혈이 관찰되었다(Table 6, 7, Fig. 6). 이는 이전의 연구에서 밝혀진 바와 같이 지용성 용매가 점성으로 인해 근관에 잘 밀착되고 수산화 이온이 천천히 유리되므로 근단부 밀폐가 유리한 것과 관련이 있다[20,27]. 또한 상아세관을 통한 치근 외면과의 연결, 치근단공이나 부근관으로 수산화 이온의 유출이 가능함을 고려한다면[28], 장기적으로 적용될수록 수용성 용매를 갖는 Metapaste®가 근단부 밀폐가 불리함을 알 수 있다. Fisher’s exact test와 Kruskal-Wallis test 결과 13주차 결과에서 재료 간 통계적으로 유의한 차이가 없었으나, 장기간의 예후를 관찰한다면 조직학적 차이가 더 크게 나타났을 가능성이 있다. 따라서 충전 후 영구치 맹출 시기까지 유지되어야 하는 유치의 치수절제술에 Metapaste®가 적용되기 위해서는 더 장기적인 추가 연구 설계가 필요하다. 그러나 지용성 제제의 근관 내 제거가 어려움을 고려할 때[25], 미성숙 영구치의 임시 첩약과 같은 단기적 근관 충전 시에는 Metapaste®가 유리할 것으로 판단된다.
한편 13주 경과 관찰 시 세 가지 재료 모두 염증 반응을 나타내는 지표의 빈도 수가 증가하였으며 림프구와 대식세포의 출현, 염증세포의 침투 및 조직의 부종 등이 추가로 나타났다. 이 결과는 적용 기간이 길어짐에 따라 치관부 수복물의 밀봉 효과가 감소한 것에 기인할 수 있다. 최근의 여러 연구들에서는 근관치료의 실패가 치관부 수복의 불량과 관련이 있음을 보고했으며[29], 근단부 밀봉보다 치관의 밀봉이 더 중요하다고 주장하는 연구도 있다[30,31]. Moskowitz 등[32]은 치수치료를 한 유구치의 임상적 성공이 치근단 감염 여부나 근관충전재의 충전보다 치수치료 후 영구적인 치관부 수복까지 걸리는 시간에 영향을 받는다고 주장했다. 이번 연구의 경우 명확한 수복물의 파절이 있는 경우 연구 결과에서 제외하였으나 관찰되지 않은 미세누출이 있었을 가능성이 있다. 특히 13주군의 경우 4주군에 비해 유지기간이 길어지면서 재료의 마모와 교합력에 의한 변형이 있었을 것으로 추측된다. 글라스아이오노머 시멘트 보다 미세누출이나 강도 면에서 유리한 resin-modified glass ionomer (RMGI) 또는 복합 레진을 사용한다면 치관부 수복의 안정성을 향상시킬 수 있을 것이다[33].
한편 수산화칼슘과 요오드포름의 복합 제제가 미생물에 대한 항균 효과를 감소시킨다는 주장도 있다[34]. Metapex®와 Endoflas®, 수산화칼슘, 산화 아연 유지놀의 항균 효과를 비교한 in vitro 연구에서 Metapex®는 다른 재료에 비해 낮은 항균 작용을 보였으며 Bacillus subtilis 외 다른 미생물의 억제 효과는 나타나지 않았다[35]. 유사한 연구에서 Vitapex®도 상대적으로 약한 항균 효과가 보고되었다[36,37]. 그럼에도 불구하고 두 제품이 여러 연구에서 임상적으로 높은 성공률을 보임을 고려할 때[15,18], 치근단부에서 조직학적인 변화가 임상적인 성공 또는 실패를 직접적으로 의미하는 것은 아닌 것으로 판단된다. 조직학적으로 염증 변화가 있는 경우도 대부분이 최소 수준인 score 1에 해당하였고, 해당 치아들이 임상 및 방사선학적으로 정상 범위였던 결과가 같은 맥락으로 설명될 수 있다.
이 연구는 비감염 모델에서 진행된 연구로 감염된 치근단에서 각 재료의 영향은 알 수 없었다. 실제 임상에서의 치수 치료는 대부분 감염 근관에서 이루어짐을 고려할 때, 각 충전재의 항균 효과와 치료 예후를 비교하기 위해서는 감염 치수 모델에서의 동물 연구가 필요할 것이다. 또한 치관부 수복물의 미세누출로 인한 영향을 최소화하기 위하여 RMGI나 복합 레진으로의 수복 재료 변화를 고려하는 것이 권유된다. 교합면 마모 및 강한 교합력으로 인한 수복물 파절을 방지하기 위해 실험 동물의 섭식을 유동식으로 관리하거나 대합치를 발거하는 것도 고려해볼 수 있다. 마지막으로 연구 기간 동안 추가적인 구강위생관리가 시행되지 않아 구강 내 세균총이 연구 결과에 영향을 주었을 가능성이 있다. 추가 연구에서는 주기적인 구강위생관리를 동반한 장기적인 관찰이 필요할 것으로 판단된다.
이 연구는 개의 치수절제술 모델에서 Vitapex®, Metapex®, 그리고 Metapaste®의 근관 적용 기간에 따른 치근단 조직의 조직병리학적 반응을 비교한 최초의 연구이다. 특히 Vitapex®는 임상적 연구가 많았던 반면, Metapex®와 Metapaste®에 대한 연구가 상대적으로 부족한 것을 고려하였을 때, 세 종류의 재료가 조직학적으로 양호한 결과를 보인 것은 고무적인 결과이다. 단, 유치의 근관 내 적용 기간과 비교하면 상대적으로 짧은 기간인 13주만에 세 재료 모두 염증반응이 증가한 양상을 고려한다면, 임상가는 근관충전재의 항균 효과뿐 아니라 근관의 형성, 근관 세척 등 근관 치료의 각 과정이 충실하게 선행 되어야 성공적인 근관 치료가 가능함을 기억해야 할 것이다. 단, 감염 근관 모델 및 장기적인 연구에서의 추가적 검증이 필요할 것으로 생각된다.
Ⅴ. 결 론
개의 치수절제술 모델에서 Vitapex®, Metapex®, 그리고 Metapaste®의 근관 적용 후 치근단 조직의 차이를 비교한 결과 재료 간 유의한 차이가 없었다. 4주군에 비해 13주군에서 다양한 염증 반응이 나타났으나 중등도 이상의 염증 반응을 나타낸 시편은 없었다. 13주군 결과 다른 두 재료에 비해 Metapaste®군에서 조직의 염증 반응 빈도와 정도가 증가하였으나 통계적으로 유의한 차이는 보이지 않았다.