치면착색제를 이용한 광역동 치료의 항균 효과
Antimicrobial Effect of Photodynamic Therapy Using Plaque Disclosing Agent
Article information
Abstract
이 연구의 목적은 치면착색제인 10 - 20 mM erythrosine을 광감각제로 사용한 광역동 치료의 항균 효과를 평가하는 것이다.
Streptococcus mutans, Lactobacillus casei, Candida albicans를 포함하는 다종 우식원성 세균막을 hydroxyapatite disc에 형성하였다. 광감각제로 20 μM, 10 mM, 20 mM erythrosine을 3분간 적용 후 24초 동안 광조사를 시행하였다. 각 실험군의 Colony-forming unit (CFU)을 측정하고 세균막을 Confocal laser scanning microscopy (CLSM)을 이용하여 관찰하였다. 10 - 20 mM erythrosine을 광감각제로 사용한 광역동 치료 실험군에서 CFU의 현저한 감소가 관찰되었고, 그 결과는 CLSM 관찰에서도 확인되었다.
이번 연구를 통해 치과 임상에서 사용되는 치면착색제를 광감각제로 이용한 광역동 치료의 높은 항균효과를 확인할 수 있었다.
Trans Abstract
The aim of this study was to evaluate the antimicrobial effect of photodynamic therapy (PDT) using plaque disclosing agent, 10 - 20 mM erythrosine, as a photosensitizer.
Multispecies cariogenic biofilms containing Streptococcus mutans , Lactobacillus casei and Candida albicans were formed on hydroxyapatite disc. 20 μM, 10 mM and 20 mM erythrosine were applied as a photosensitizer for 3 minutes, and then light-emitting diode (LED) irradiated for 24 seconds. Colony-forming unit (CFU) were measured and biofilms were observed using confocal laser scanning microscopy (CLSM). CFU were significantly decreased in the PDT groups using 10 - 20 mM erythrosine (10 mM, 20mM) and the results were also confirmed by CLSM.
This study confirms the high antimicrobial effect of photodynamic therapy using plaque disclosing agent as a photosensitizer.
Ⅰ. 서 론
광역동 치료(Photodynamic therapy, PDT)란 빛으로 광감각제를 활성화시킬 때 발생되는 활성 산소가 세포 사멸을 유도하는 원리를 이용한 치료이다[1]. 광역동 치료는 항생제와 달리 정상 세균총을 파괴하지 않고 내성균 발현의 부작용이 없으며, 치료 효과는 빛이 조사되는 범위에 제한된다는 장점을 갖는다[2].
Wood 등[3]은 22 μM의 methylene blue, photofrin, erythrosine을 광감각제로 이용한 실험에서 erythrosine이 가장 효과적임을 보고하였다. 이후 많은 광역동 치료 실험에서 광감각제로 erythrosine이 이용되고 있다. 한편 9 - 25 mM의 erythrosine은 치과 임상에서 널리 이용되는 치면착색제이다.
앞선 연구들에서 광감각제로 쓰이는 erythrosine의 농도가 높아질수록 광역동 치료의 항균 효과는 커지는 것으로 나타났다[4,5]. 하지만 비교에 사용된 erythrosine의 농도는 치면착색제로 쓰이는 농도보다 1000배가량 낮은 농도였다.
이번 연구의 목적은 치면착색제로 쓰이는 10 - 20 mM의 erythrosine을 광감각제로 이용하였을 때 광역동 치료의 항균 효과를 평가해보는 것이다.
Ⅱ. 연구 재료 및 방법
1. 세균과 배양 조건
다종 우식원성 세균막 형성을 위해 Streptococcus mutans ATCC 25175, Lactobacillus casei ATCC 334 표준 균주와, 유아기 우식증 환자에서 더 높은 비중으로 존재하며 유아기 우식과 높은 연관성을 갖는 것으로 보고되고 있는 Candida albicans KCTC 7270 표준 균주를 사용하였다[6]. 배양된 각 세균은 접종을 위해 인산완충생리식염수(phosphate-buffered saline, PBS)를 이용하여 1 x 109 CFU/mL로 희석하였다[7].
2. 세균막(biofilm) 형성
세균막은 hydroxyapatite (HA) disc에 형성하였다. 먼저 12- well cell culture plate에 HA disc를 위치시킨 후 brain heart infusion (BHI) broth 2910 μL와 각 세균 희석액 30 μL를 접종하였다. 각 세균의 최종 접종 농도는 1 x 107 CFU/mL였다. 세균막 형성을 위해 배지는 37℃ 배양기에서 24시간 동안 보관하였다.
3. 광감각제
Erythrosine (Sigma-Aldrich, St Louis, MO, USA)을 광감각제로 사용하였다. Erythrosine의 농도는 앞선 연구들에서 사용되었던 광감각제 농도인 20 μM과[8], 치면착색제 농도에 해당하는 10 mM, 20 mM로 설정하였다. Erythrosine의 분자량은 879.86 g/mol이며 분말 상태의 erythrosine을 PBS와 혼합하여 20 mM erythrosine 용액을 제조 후 PBS로 희석하여 20 μM, 10 mM의 erythrosine을 제조하였다. 각 농도의 erythrosine은 여과 살균 후 -20℃ 암실 상태에서 보관하여 사용하였다.
4. 광원
VALO light-emitting diode (LED) 광중합기(Ultradent Products Inc, South Jordan, UT, USA)를 Xtra Power mode로 설정하여 광원으로 사용하였다. 조사 거리는 10 mm로 설정하였으며 이 거리에서 radiometer를 이용한 측정 시 광도는 1800 mW/cm2였다.
5. 광역동 처치
광감각제 농도, 광조사 여부에 따라 총 8개의 군을 설정하였고 군 당 4개의 시편을 제작하여 처리하였다. Ⅰ군에는 erythrosine 대신 PBS를 적용 후 광조사는 시행하지 않았다(0 L-). Ⅱ군에는 PBS 적용 후 광조사만을 시행하였다(0 L+). Ⅲ군에는 20 μM erythrosine만을 적용하였고(20μM L-), Ⅳ군에는 20 μ M erythrosine 적용 후 광조사를 시행하였다(20μM L+). Ⅴ군에는 10 mM erythrosine만을 적용하였고(10mM L-), Ⅵ군에는 10 mM erythrosine 적용 후 광조사를 시행하였다(10mM L+). Ⅶ군에는 20 mM erythrosine만을 적용하였고(20mM L-), Ⅷ군에는 20 mM erythrosine 적용 후 광조사를 시행하였다(20mM L+). 앞선 연구를 참고하여, 광감각제는 3분 동안 적용하였고 광조사는 24초 동안 시행하였다[8]. 처리된 시편을 초음파 처리하여 세균 부유액을 만든 후 PBS로 희석하여 혈액 한천 배지(blood agar plate)에 도말, 배양 후 CFU를 측정하였다.
6. 공초점 레이저 현미경(Confocal laser scanning microscopy, CLSM) 관찰
처리 방법에 따른 세균의 생존 상태를 비교하기 위해 공초점 레이저 현미경 관찰을 시행하였다. 처리한 시편을 암실에서 Live/Dead Baclight (Molecular Probe, Eugene, OR, USA)로 15분 동안 염색 후 LEICA TCS SP8 공초점 현미경을 이용하여 관찰하였다.
7. 통계 처리
SPSS 22 (SPSS Inc, Chicago, IL, USA)를 이용하여 통계 분석을 시행하였다. 통계적 유의성은 Bonferroni test 사후 분석 방법으로 분석하였다.
Ⅲ. 연구 성적
1. Colony-forming unit (CFU) 측정
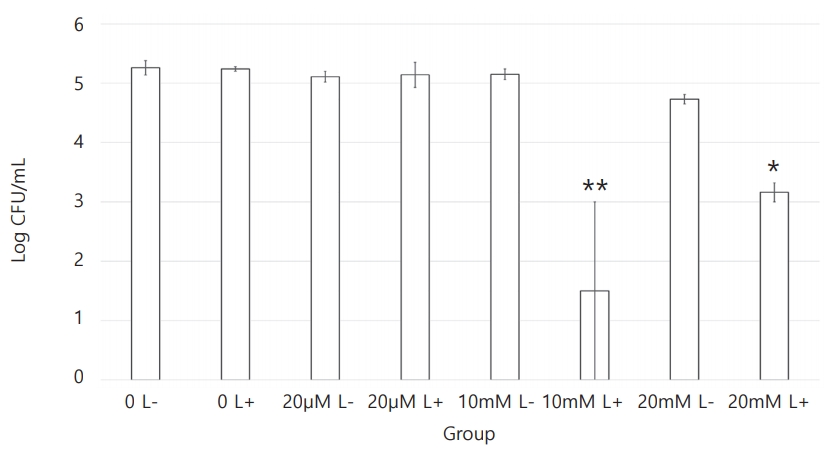
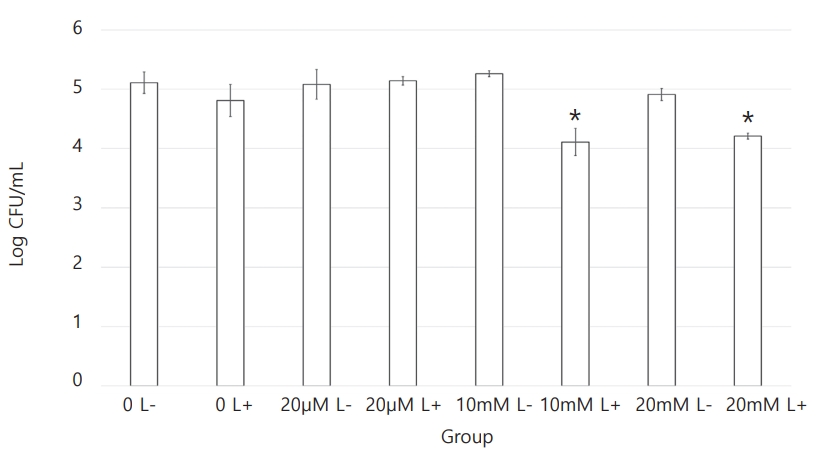
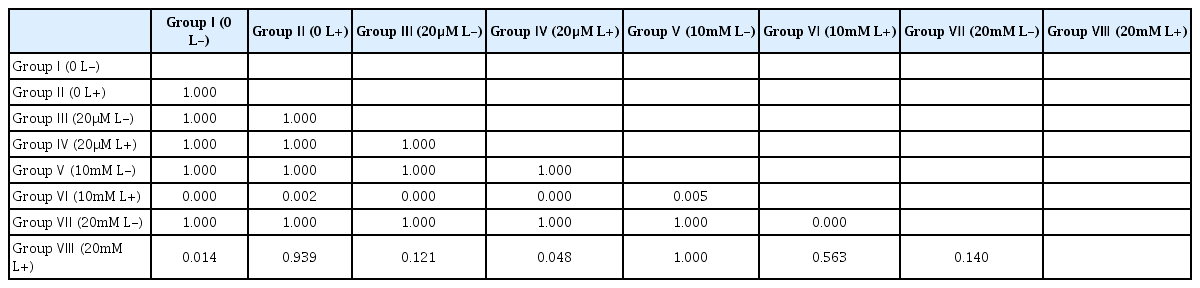
각 세균의 CFU 측정 결과를 Table 1에 정리하였다. S. mutans , L. casei , C. albicans 세 균 모두에서 치면착색제 적용 후 광조사를 시행한 Ⅵ군과 Ⅷ군에서 CFU 값의 감소가 관찰되었다(Fig. 1 - 3). 10 mM erythrosine 적용 후 광역동 치료를 시행한 Ⅵ군의 CFU 값은 S. mutans와 C. albicans에서 Ⅷ군을 제외한 다른 모든 군보다 유의하게 작았다. L. casei에서는 Ⅵ군의 CFU 값이 20 mM erythrosine 적용 후 광역동 치료를 시행한 Ⅷ군을 포함하여 다른 모든 군보다 유의하게 작았다. 한편, S. mutans에서 Ⅷ군의 CFU 값은 Ⅰ군과 Ⅳ군보다만 유의하게 작았고, L. casei와 C. albicans에서는 Ⅷ군의 CFU값이 Ⅵ군을 제외한 모든 군보다 유의하게 작았다. 10 mM 및 20 mM erythrosine 적용 후 광역동 치료를 시행한 군을 제외한 다른 군 사이에는 유의한 차이가 관찰되지 않았다(Table 2 - 4).
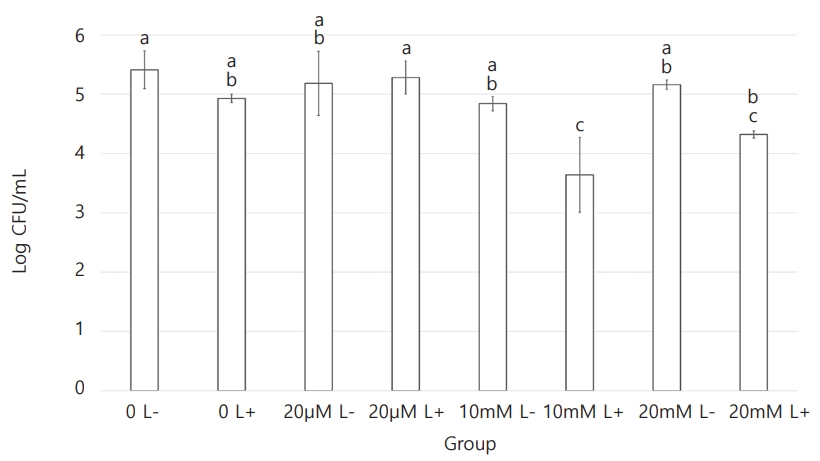
Mean and standard deviation of Streptococcus mutans bacterial count. Means with the same letter are not significantly different.
2. 공초점 레이저 현미경(CLSM) 관찰
CLSM을 이용하여 살아 있는 세포는 초록색 형광으로, 죽은 세포는 빨간색 형광으로 관찰할 수 있었다(Fig. 4). 또한, 초록색 형광과 빨간색 형광의 colocalization 분석이 Pearson’s correlation analysis를 통해 산점도(scatter plot) 또는 fluorogram이라 불리는 pixel distribution diagram으로 도식화되었다(Fig. 5).

Confocal laser scanning microscopy images of Live & Dead cells in multispecies biofilm. (A) Group Ⅰ, (B) Group Ⅱ, (C) Group Ⅲ, (D) Group Ⅳ, (E) Group Ⅴ, (F) Group Ⅵ, (G) Group Ⅶ, (H) Group Ⅷ.

Scatter plots corresponding to the Live & Dead cell colocalization. (A) Group Ⅰ, (B) Group Ⅱ, (C) Group Ⅲ, (D) Group Ⅳ, (E) Group Ⅴ, (F) Group Ⅵ, (G) Group Ⅶ, (H) Group Ⅷ
Ⅰ, Ⅱ, Ⅲ, Ⅴ군에서는 전반적으로 초록색 형광이 강화되어 관찰되었고, 상대적으로 Ⅳ군에서는 빨간색 형광의 강도가 증가하였다. 한편 Ⅵ군과 Ⅷ군에서는 빨간색 형광이 강화되어 관찰되었고 특히 Ⅵ군에서는 매우 강한 빨간색 형광이 지배적이었다. Ⅶ군에서는 높은 비중의 강한 초록색 형광과 함께 낮은 비중의 빨간색 형광이 분리되어 분포하는 것이 관찰되었고, 이와 같이 초록색과 빨간색의 분포가 분리되는 경향은 Ⅷ군에서도 나타났다.
Ⅳ. 총괄 및 고찰
10 - 20 mM erythrosine, 즉 치면착색제를 이용하여 광역동 치료를 시행한 경우 유의하게 훨씬 더 높은 항균 효과가 나타났다. 치면착색제보다 1000배 정도 낮은 농도의 erythrosine을 광감각제로 이용한 연구에서는 erythrosine의 농도가 높아질수록 광역동 치료의 항균 효과가 높아지는 것이 보고되어 왔다[4-5,7]. 한편, 임상에서 사용되는 치면착색제인 10 - 20 mM erythrosine을 광감각제로 직접 이용할 경우 광역동 치료의 항균 효과는 훨씬 더 높아지는 것이 이번 연구에서 확인되었다. 하지만 치면착색용 erythrosine 농도 범위 안에서 광역동 치료 시, 앞선 연구들의 결과와 달리 erythrosine의 농도가 높아질수록 항균 효과가 오히려 낮아지는 경우가 관찰되었다(p= 0.027). Gong[9] 등은 세균막 상태 S. mutans의 erythrosine 자체에 대한 감수성을 평가하였고 3.7 mM에서 정균 효과가, 30 mM에서 살균 효과가 나타남을 보고하였다. Erythrosine에 대한 L. casei , C. albicans의 감수성은 아직 보고되지 않았고 세균의 감수성은 세균막의 표면 상태 및 약제 노출 시간에 따라서 달라지지만, 9 - 25 mM의 erythrosine인 치면착색제는 그 자체만으로 어느 정도 항균 효과를 갖고, 그 효과는 농도가 높아질수록 커질 것으로 사료된다. 하지만 광역동 치료를 위해서는 빛이 필요하며 높은 농도의 광감각제는 자체 차폐(self-shielding) 현상에 의해 빛이 투과하는데 있어 불리하게 작용한다[10]. 치면착색제 범위에서 빛을 조사하지 않을 때에는 erythrosine 농도가 높은 경우 자체의 항균 효과가 높아질 수 있으나, 빛이 조사되는 경우 erythrosine 농도가 높아져도 항균 효과는 차이가 없거나 오히려 낮아지는 데에는 이 자체 차폐 현상이 영향을 미쳤을 수 있다.
처리 방법에 따른 항균 효과는 CLSM을 이용해 시각화 될 수 있었다. 초록색 빨간색 형광 중첩 영상에서 치면착색제를 이용한 광역동 치료 시 죽은 세포의 비율이 확연히 높아진 것이 관찰되었다(Fig. 4). 이때, 산점도(scatter plot)는 세균막의 전반적인 상태를 더 구체적으로 보여줌과 동시에 국소적인 양상에 대한 논의를 가능케한다 (Fig. 5)[11]. Ⅰ, Ⅱ, Ⅲ, Ⅴ군에서 초록색 형광을 나타내는 X축으로 치우친 점들의 분포는 세균막내 살아있는 세포의 우세함을, Ⅵ군에서 빨간색 형광을 나타내는 Y축으로 치우친 점들의 분포는 세균막 내 죽은 세포의 우세함을 보여준다. 한편, Ⅳ군에서 Ⅰ, Ⅱ, Ⅲ, Ⅴ군에 비해 넓어진 스펙트럼은 죽은 세포의 비율이 높아진 상태를 반영한다. Ⅶ군에서는 강한 초록색 형광을 띄는 세포들과 구분된 강한 빨간색 형광을 띄는 세포들이 일부 존재하는 것이 관찰되며, 이는 20 mM erythrosine에 대해 감수성을 갖는 세균의 특이적 사멸 때문일 가능성이 있다. Ⅷ군의 산점도에서도 죽은 세포와 살아있는 세포가 구분되어 분포하는 양상이 나타난다. 그 원인은 고농도 erythrosine에 대한 감수성과 더불어 빛이 세균막에 분포하는 전체 세균들에 효과적으로 도달하는 것이 자체 차폐 현상에 의해 방해되었기 때문일 수 있다. 하지만 이러한 논의들을 명확히 하기 위해서는 각 세균의 erythrosine에 대한 감수성 평가와 함께, erythrosine 농도에 따른 빛의 투과율 등에 대한 추가적인 연구가 필요하다.
광역동 치료는 현재 암세포를 표적 세포로 한 항암 치료, 피지선 파괴를 통한 여드름 치료 등에 이용되고 있으며, 치과 영역에서의 광역동 치료는 근관 감염, 우식, 치주 질환을 포함한 구강 감염의 치료 도구로 연구되고 있다[12]. 진료실에서 현재 단계의 광역동 치료가 약물을 이용한 항균 요법 및 기존의 치과 치료를 대체할 수는 없지만 구강 감염 관리를 위한 유망한 비침습적 보조 수단으로 간주되고 있다[13]. 한편 광감각제와 광원만으로 항균 효과를 갖는 특성은 광역동 치료가 일상 구강 관리 보조 수단으로 적용될 수 있다는 잠재성을 포함하며, 기존의 치면착색제는 광역동 치료의 광감각제로 이용될 수 있다.
Ⅴ. 결 론
이번 연구에서는 치과 임상에서 치면착색제로 널리 쓰이는 10 - 20 mM erythrosine을 광감각제로 이용한 광역동 치료의 항균 효과를 평가해 보았다.
치면착색제인 10 - 20 mM erythrosine을 이용한 광역동 치료는 다종 우식원성 세균막에 대해 높은 항균 효과를 보였다.