â
. ě ëĄ
ěšě ě°ěěŚě ě ě¸ęłě ěźëĄ ę°ěĽ íí ë§ěą ë° ě ěźěą ě§íě´ëŠ°, 쥰ěŹě ë°ëĽ´ëŠ´ 10ě¸ ëŻ¸ë§ íęľ ěëě ěšě ě°ěěŚě ěľęˇź 9ë
ę° ęž¸ě¤í ěŚę°íë ěśě¸ě´ë¤[
1,
2]. ěšě ě°ěěŚě 죟ěí ěě¸ ě¤ íëë ě¸ęˇ ë° íěĄě 기ěě ë ě¤íŠě˛´ 기ě§ě 돝í ěë 미ě돟 ęľ°ë˝(Microbial community)ě¸ ěšíě´ë¤[
3].
Mutans streptococcië ěšíě íěąě ě¤ěí ěí ě í늰, ꡸ ě¤
Streptococcus mutansë ě ě°Š, ě°ěěą, ě°ë´ěąě íšěąě ę°ě§ěźëĄě¨ ěšíě í경ě ëłíěěź ěšě ě°ěěŚě ě§íě 기ěŹíę˛ ëë¤[
4].
ěšě ě°ěěŚě 쥰ě ě ěí 기쥴ě ë°Šë˛ë¤ě ěšíě 기ęłě ě ęą° ë° íęˇ ě ëë íěě ě ěŹěŠě íŹí¨íë¤. ꡸ëŹë ě´ ë°Šë˛ë¤ě ęľŹę° ě ë§ě 기ęłě ěě, ě ě ě¸ęˇ ě´ ëśę´´, ěšě ë° ě볾돟 ě°Šě ëąě íęłě ě ę°ě§ë¤[
5]. ę´ěë ěšëŁ(Photodynamic therapy, PDT)ë ę´ę°ę°ě ě ę´ë§¤ę° íěąíě ěí´ ěěąëë ě¸íŹ ë
ěą ë°ěěą ě°ěě˘
(Cytotoxic reactive oxygen species), ěŁźëĄ ěźě¤í ě°ě(Singlet oxygen)ě ěěąě ěźę¸°íë ě°ě ě쥴ě ę´íí ë°ěěźëĄ, ěšě ě°ěě ěíëę° ëęł í쥰ëę° ëśëí íěěę˛ PDTë ěšě ě°ěěŚ ěë°Šě ěí ěëĄě´ ě ꡟ ë°Šë˛ě´ ë ě ěë¤[
5,
6].
ěě ë° ě°ęľŹěě ěŹěŠëë ę´ę°ę°ě ëĄë Erythrosine, Toluidine blue O, Methylene blue, Eosin, Rose Bengal, Malachite green, Porphyrin ëąě´ ěěźëŠ°, ěľęˇźěë Indocyanine Green(ICG)ě´ PDT뼟 ěí ěëĄě´ ę´ę°ę°ě ëĄ ěę°ëěë¤[
7]. ICGë 750 - 900 nm ěěě ꡟě ě¸ě (Near Infrared, NIR)ě íĄěí늰, ëŻ¸ęľ ěíěě˝ęľ(Food and Drug Administration, FDA)ě ěí´ ěě ěŠëëĄ ěšě¸ë ě ěźí NIR ěźëŁě´ë¤. ICGë ëšě íĄě ě´íě íę´ ë°Šěś, ë°ěěą ě°ěě˘
ěěą, ě´ ë°ěě í¨ęłźëĽź ëíëź ě ěëë°, ě´ ë°ě í¨ęłźëĄ ě¸í´ ICGě ěí´ ë§¤ę°ëë ę´ ë°ěě ę´ě´ ěšëŁ(Photothermal therapy, PTT)ëĄ ě ěë기ë íë¤[
8]. PTTë ëšě 쥰ěŹí´ ě´ě ë°ěěí´ěźëĄě¨ ęľěě ě¸ ę°ě´ě íľí´ ě¸íŹëĽź ě íě ěźëĄ ěŹëŠ¸ěí¤ë ěšëŁë˛ě ëťíë¤[
9].
ICGě NIR ë¤ě´ě¤ë ë ě´ě ě ěí ę´ë°ěě´
S. mutansě ě쥴ě 미ěšë ěíĽě íę°íë ě°ęľŹę° ě´ëŁ¨ě´ě§ęł ěě§ë§,
S. mutans ě¸ęˇ ë§(biofilm)ě ëí ěíĽě íę°í ě°ęľŹë ęą°ě ěë¤[
1]. ě¸ęˇ ë§ě ë¤ě¤ 매í¸ëŚě¤ 꾏쥰뼟 ě´ëŁ¨ě´ íęˇ ě ě 욨íŹëĽź ë§ěźëŻëĄ, ëśě ěíě 미ě돟 ëł´ë¤ ě¸ęˇ ë§ ěíě ě¸ęˇ ě ěľě íë ę˛ě´ í¨ěŹ ě´ë ľë¤. ë°ëźě ěšě ě°ěěŚ ěë°Šě ěí íęˇ í¨ęłźëĽź íę°í기 ěí´ěë ě¤íěě ě¸ęˇ ë§ě ëí í¨ęłźëĽź íę°íë ę˛ě´ íěíë¤.
ë°ëźě ě´ë˛ ě°ęľŹě 몊ě ě ě¤íě¤ í경ěě NIR ë¤ě´ě¤ë ë ě´ě ě 쥰ěŹëĽź íľí ICGě ę´ë°ěě´ S. mutans ě¸ęˇ ë§ě 미ěšë í¨ęłźëĽź ě ëě , ě ěąě ěźëĄ íę°íęł , ě´ ę´ë°ěěźëĄëśí° ë°ěíë ě¨ë ěěšě ę´ě°°íěŹ ěšě ě°ěěŚ ěë°Šě ěí ěěě ěŹěŠě ę°ëĽěąě ěěëł´ë ę˛ě´ë¤.
â
Ą. ě°ęľŹ ěŹëŁ ë° ë°Šë˛
1. ě¸ęˇ ë°°ě
S. mutans ATCC25175 ęˇ ěŁźëĽź 5% CO2, 37°Cě 쥰깴ěě 18ěę° ëě Brain heart infusion broth(BHI, Becton, Dickinson and Company, Sparks, MD, USA)ěě ë°°ěíěë¤. ě¸ęˇ íźíěŠěĄě íźíë뼟 ëśę´ ę´ëęł(Smart Plus 2700; Young-woo inst., Seoul, Korea)ëĄ ě¸Ąě íěŹ ě´ ě¸ęˇ ě뼟 ě°ě í í, BHI broth뼟 ě´ěŠíěŹ 107 Colony Forming Unit/mL(CFU/mL)ëĄ íŹěíěë¤.
2. ě¸ęˇ ë§(Biofilm) íěą
Hydroxyapatite(HA) disk(ě§ę˛˝ 1.27 cm, Biosurface Technologies Corporation, Bozeman, MT)ě í 늴ěě ę°ëĄ 8.0 mm, ě¸ëĄ 2.0 mm íŹę¸°ě 늴ě ě ë¨ę¸°ęł 모ë ę˛ě ě Nail varnish뼟 ë°ëĽ¸ í, ë°ë쪽 늴곟 ě늴ěë ě¤ëŚŹě˝ ěŹëŁ(Examixfine injection type; GC Corporation, Tokyo, Japan)뼟 ëíŹíěë¤. EO gasëĄ ëŠ¸ęˇ í HA disk뼟 12-well cell culture plateě ëŁęł , BHI broth 1980 ÎźLě 107 CFU/mLě S. mutans ë°°ěěĄ 20 ÎźL뼟 ě ě˘
íěŹ 5% CO2, 37°Cě 쥰깴ěě 24ěę° ëě S. mutans ě¸ęˇ ë§ě íěąěěź°ë¤.
3. ę´ę°ę°ě ě ę´ě
ICG(Sigma-Aldrich, St. Louis, MO, USA) ëśë§ě ëŠ¸ęˇ ěŚëĽě(Sterile distilled water)ě ěŠí´ěěź ę°ę° 0.5, 1.0, 2.0, 3.0, 4.0, 5.0 mg/mL ě ëëëĄ ě 쥰íěë¤. ěŠěĄě ěě ěąě ęł ë ¤íěŹ ě 쥰ë ě¤í ě§ě ě ě´ëŁ¨ě´ěĄěźëŠ°, ěě¤ě ëł´ę´í늴ě ě¤íě ěŹěŠíěë¤.
ę´ěěźëĄë ę°ëĄ 6.0 mm, ě¸ëĄ 1.0 mm íŹę¸°ě ě§ěŹę°í 모ěěźëĄ 쥰ěŹë늰 810 nmě íěĽęłź 300 mW ěśë Ľě ę°ě§ë ë¤ě´ě¤ë ë ě´ě (808MD-300-1245, Laserland, Besram Technology Incorporation, Hengelo, Nertherlands)뼟 ěŹěŠíěęł , Radiometer(DigiRate LM-100; Monitex, New Taipei city, Taiwan)뼟 ě´ěŠíěŹ ěśë Ľě íě¸íěë¤.
4. ě¸ęˇ ë§ě ě˛ěš
S. mutans ě¸ęˇ ë§ě´ íěąë HA diskę° ë¤ě´ěë ę° wellěě ë°°ěěĄě ě ęą°íęł 0.5, 1.0, 2.0, 3.0, 4.0, 5.0 mg/mL ëëě ICG ěŠěĄ 10 ÎźL뼟 Biofilm ěě ëíŹí í 5ëśę° ěě¤ě ëł´ę´íěë¤. ꡸ ë¤ě 30ě´ ę° ę´ěĄ°ěŹëĽź ěííěë¤. ëëě ë°ëĽ¸ í¨ęłźëĽź ëšęľí기 ěíěŹ ë¤ěęłź ę°ě´ ęľ°ě ëśëĽíěë¤(
Table 1).
5. Colony Forming Unit(CFU) 츥ě
ę° ěĄ°ęą´ě ë°ëĽ¸ ě˛ëŚŹ í, ę° wellě 10ě´ę° ë ë˛ ě´ěí ě˛ëŚŹ(VC 100; Sonics & Materials Inc., Danbury, CT, USA)íěŹ ě¸ęˇ ëśě ěĄěźëĄ ë§ë¤ěë¤. ę° well ëš ë ę°ě Blood agar plate(Hanil-KOMED, Seongnam, Gyeonggi-do, Korea)뼟 ě´ěŠíěŹ ę°ę° 50 ÎźLě ë°°ěěĄě ëë§í íě 5% CO2, 37°Cě 쥰깴ěě 72ěę° ëě ë°°ěíěë¤. CFU뼟 츥ě íěŹ ëĄęˇ¸ę°ě 꾏í í, ę° ěĄ°ęą´ě ë°ëĽ¸ íęˇ í¨ęłźëĽź ëšęľíěë¤.
6. ě¸ęˇ ë§ í늴ě ě¨ë ëłí
ë쥰꾰 ë° â
Ąęľ°ęłź â
Łęľ°ě ěí¸ë¤ě´ S. mutans ě¸ęˇ ë§ í늴ě ě¨ë 츥ě ě ěí´ě ěŹěŠëěë¤. ę° ěĄ°ęą´ě ë°ëĽ¸ ě˛ëŚŹ í, ę´ěĄ°ěŹ ě ě ěí¸ í늴ě 1ěąë ě´ě ë ě¨ëęł(Testo 925, Testo, Lenzkirch, Germany)ě ě°ę˛°ë Thermocouple(Serie/Batch 5971, Thermocoax, Suresnes, France)ě ěěšěí¤ęł ę´ěĄ°ěŹě ë°ëĽ¸ ě¨ë ëłí뼟 츥ě íěë¤.
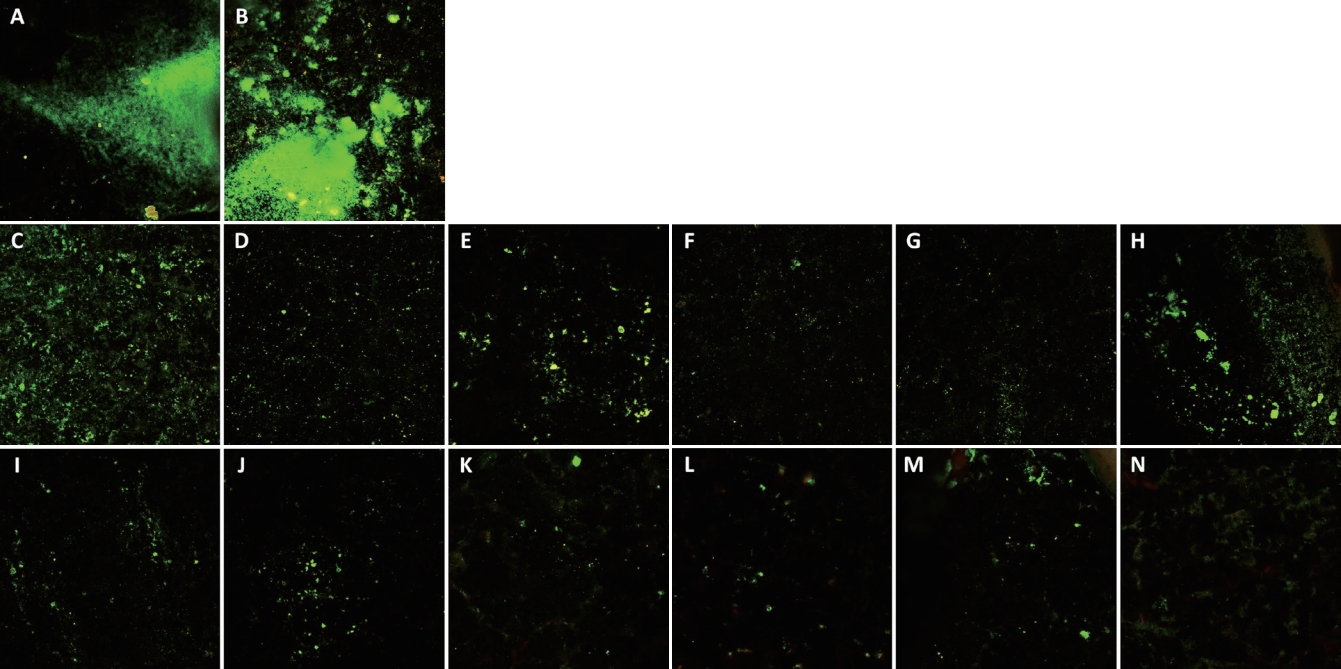
7. ęłľě´ě ë ě´ě ěŁźěŹ í미경 (Confocal laser scanning microscopy, CLSM) ę´ě°°
ěěĄ´ë Ľě ěę°í뼟 ěí´ ëŞ¨ë S. mutans ě¸ęˇ ë§ í본ě ęłľě´ě ë ě´ě í미경ěźëĄ íę°íěë¤. 모ë ěí¸ě 1000 ÎźL PBSëĄ 2í ě¸ě˛íęł , SYTO-9(ë
šě, ě쥴 ě¸íŹ) ë° íëĄíźëě ěě¤ëí돟(ě ě, ěŹëŠ¸ ě¸íŹ)ě í¨ě íë 200 ÎźLě LIVE/DEAD BacLight Bacterial Viability Kit ěŠěĄ(Molecular Probes, Inc., Eugene, USA)ě ě ěŠíěŹ ě 쥰ě
체ě ě§ěě ë°ëź ěě¤ěě 15ëś ëě ě¤ě¨ěě ěźěíěë¤. ěźě íě ě¸ęˇ ë§ě 200 ÎźLě Double distilled water(DDW)ëĄ ëśëë˝ę˛ íšęľŹěë¤. ꡸ ë¤ě HA disk뼟 ěŹëźě´ë ę¸ëźě¤ëĄ ěŽę¸°ęł , ęłľě´ě í미경(LEICA TCS SP8, Leica Microsystem, Wetzlar, Germany)ě íľí´ 10ë°° ë°°ě¨ëĄ ę˛ěŹíěë¤.
8. íľęł ëśě
SPSS ë˛ě 22.0(SPSS Inc., Chicago, IL, USA)ě ěŹěŠíěŹ Log10 CFU/mL ę°ě ëí íľęł ëśěě ěííěë¤. Bonferroni test ěŹí ëśě ë°Šë˛ě ě ěŠíěë¤.
â
Ł. ě´ę´ ë° ęł ě°°
ICGë ę°ěě ëěŹëęł 50 - 80 mg/kgě ë°ě ěšěŹë(Lethal dose 50%)ě ę°ě§ëŠ° ěĽě ë§ě íĄěëě§ ě기 ë돸ě ě ë
ěąěźëĄ ëśëĽëë¤[
8]. ě´ëŹí ëě ěě ěą ë돸ě ICGë ěíę´ ěĄ°ěě ë° ę° ę¸°ëĽ ę˛ěŹ ëąě ěëŁ ěěě ë댏 ěŹěŠëęł ěë¤[
8]. ICGě ěí´ ë§¤ę°ëë ę´ë°ěě ě°ě ěě´ë ë°ěí ě ěëë°, ě´ëŹí íšěą ë돸ě ěšęłź ěěěěë ěŁźëĄ íę¸°ěą ě¸ęˇ ě ěí´ ë°ěíë ěšěŁź ě§í ëë ęˇźę´ ë´ ę°ěźě 쥰ě ě ěí ěëĄě´ ěšëŁ ë°Šë˛ěźëĄ ěę°ëěë¤[
10,
11]. ꡸ëŹë íęˇ í¨ęłźëĽź ěí ěľě 쥰깴ě ëí ě°ęľŹë ëśěĄąí늰, ę° ě°ęľŹë¤ ë§ë¤ ěŹěŠë ICGě ëëë ěźę´ěąě´ ěë¤. ě´ě ě°ęľŹë¤ě ě´í´ëł´ëŠ´, ěŹěŠë ICGě ëëë ëśě ěíě ě¸ęˇ ěě 1.9 - 1000 ÎźL/mL, ě¸ęˇ ë§ ěíě ě¸ęˇ ěě 5 mg/mLęšě§ëĄ ë¤ěíěë¤[
1,
11,
12]. ě´ë˛ ě°ęľŹěěë ě¸ęˇ ë§ěě íęˇ ě ě ę°ěěąě´ ëŽě ę˛ě ęł ë ¤íěŹ ëšęľě ëě ëëě ICGěŠěĄě ěŹěŠíěŹ
S. mutans ě¸ęˇ ë§ě ëí í¨ęłźëĽź íę°íěë¤.
810 nm NIR ë¤ě´ě¤ë ë ě´ě ë ěšęłźěě íí ěšěŁź ěšëŁ, ěíëí¸ ěŁźěěź, ęˇźę´ ë´ ę°ěźě 쥰ě , ěšě 미밹 ëąě ěŹěŠë늰, 쥰ě§ě ęľěě ě¸ ě¨ë ěěšě íľí´ íęˇ í¨ęłźëĽź ëíë´ë íšě§ě ę°ě§ë¤[
13]. Giraudeau ëą[
8]ě ICGě 5 - 10 W/cm
2ě ěśë Ľě ę°ě§ ę´ěě ě´ ëë ëśě ë
¸ěśěę°ěźëĄ ě ěŠí늴 ę´ë
ěąě´ ëíë ě ěë¤ęł íěë¤. ě´ë˛ ě°ęľŹěěë NIR ë¤ě´ě¤ë ë ě´ě ě ICGëĄ ě¸í ě¨ë ěěšě´ ěŁźëł ěĄ°ě§ęłź ěšě§ě 미ěšë ěěě ěľěíí ě ěëëĄ 5 W/cm
2ě ëšęľě ëŽě ěśë Ľě ę°ě§ë NIR ë¤ě´ě¤ë ë ě´ě 뼟 ę´ěěźëĄ ěŹěŠíěë¤.
ICGě NIRë¤ě´ě¤ë ë ě´ě ě ěí íęˇ í¨ęłźě 기ě ě ëí´ěë ěě§ ë
źěě´ ě§í ě¤ě´ë¤. Reindl ëą[
14]ě 츥ě ë ěźě¤í íěąě ěě ěě¨(Quantum yields of triplet formation)ě´ í¨ě¨ě ě¸ ë°ěěą ě°ěě˘
, íší ěźě¤í ě°ě뼟 ěěąí기ě 윊ëśí ëë¤ęł ě ěí¨ěźëĄě¨ ICGě NIR ë¤ě´ě¤ë ë ě´ě ě ěí ę´ë°ěě´ PDTěź ě ěěě ëˇë°ěš¨íěë¤. ëí ICGě ě ě ë Ľ ë°ë뼟 ę°ě§ ę´ěě ě ěŠí늴 PDT뼟 íľí ę´ë
ěąě´ ëíëęł , ě´ ëë ě´ě ë뼟 íľí 윊ëśí ëę°ěźëĄ ě¸í´ ě¸íŹë 쥰ě§ěě ě¨ë ěŚę°ę° ęą°ě ę°ě§ëě§ ěëë¤ęł íë 죟ěĽë ěë¤[
8]. ꡸ëŹë Engle ëą[
15]ě ěźě¤í ě°ěě ě§ě ě ě¸ ę˛ěśě ëí ěŚęą°ë ěë¤ęł 죟ěĽíěěźëŠ°, ë¤ëĽ¸ ě°ęľŹěěë 100 mWě 300 mWě 810 nm NIR ë¤ě´ě¤ë ë ě´ě 뼟 ICGě ě ěŠíě ë ěľë 80âęšě§ě ě¨ë ěěšě ëł´ęł íěë¤[
16].
ě´ë˛ ě°ęľŹěě NIR ë¤ě´ě¤ë ë ě´ě 쥰ěŹë§ě ěíí â
Ąęľ°ęłź 5 mg/mL ICG ěŠěĄě ę´ěĄ°ěŹëĽź í¨ęť ěíí â
Ł-6ęľ°ě ě¸ęˇ ë§ í늴 ě¨ë ěěšě ëšęľíě ë, ꡸ ě¨ë ě°¨ě´ë 5.23â ě´ěë¤. ě´ëŹí ę˛°ęłźëĄ ëŻ¸ëŁ¨ě´ ëłź ë ICGě NIR ë¤ě´ě¤ë ë ě´ě ě ěí ë°ě´ í¨ęłźë ICGě ę´ë°ěě ěí ě´ ë°ěęłź NIR ë¤ě´ě¤ë ë ě´ě ě ěí ę°ě´ ěěŠě´ í¨ęť ěěŠíěŹ ëíëë ę˛ěźëĄ ëł´ě¸ë¤. ꡸ëŹë ě´ëŹí 결곟뼟 íľí´ ICGě NIR ë¤ě´ě¤ë ë ě´ě ě ěí íęˇ í¨ęłźě 기ě ě´ ë°ěěą ě°ěě˘
ěěąě 기ě´í ę´ííě í¨ęłźëĽź ě´ěŠíë PDTě¸ě§, ěŹę¸°ë ěźě¤í ěíě ë ě´ě ëĄëśí° ë°ěíë ě´ě ě´ěŠí PTTě¸ě§ëĽź 꾏ëśíë ę˛ě ě´ë ľë¤. ë°ëźě ICGě NIR ë¤ě´ě¤ë ë ě´ě 뼟 ě´ěŠí ę´ë°ěě ěŠě´ ě ěë ě ě¤í´ěź íë¤.
Fatma ëą[
1]ě ICG ěŠěĄ ë§ě ëíŹí 경ě°ěë ě¸ęˇ ěę° ę°ěíě§ë§, NIR ë¤ě´ě¤ë ë ě´ě 뼟 í¨ęť 쥰ěŹíě ëë ë í° ě¸ęˇ ěě ę°ěę° ę´ě°°ëë¤ęł ëł´ęł íěë¤[
1]. ě´ë˛ ě°ęľŹěěë 3.0, 4.0, 5.0 mg/mLě ICG ěŠěĄ ë§ě ëíŹí â
˘-4, 5, 6ęľ°ěě ě¸ęˇ ěę° ę°ěíë ěěě´ ę´ě°°ëěë¤. ě´ë
S. mutans ě¸ęˇ ë§ě´ ęł ëëě ICG ěŠěĄ ě체ě ěíĽě ë°ěęą°ë, ěí¸ě ěě¤ě ëł´ę´í늰 ëšě ëí ë
¸ěśě ěľěííě§ë§ ëśę°íź íę˛ ěźě´ë ëšě ë
¸ěśě ěí ICGě ę´ë°ěě ěí ę˛ěźëĄ ěŹëŁëěë¤.
ëí ě´ë˛ ě°ęľŹěě 1.0, 2.0, 3.0, 4.0, 5.0 mg/mLě ICGě NIR ë¤ě´ě¤ë ë ě´ě 뼟 í¨ęť ě ěŠí â
Ł-2, 3, 4, 5, 6ęľ°ěě ëëę° ěŚę°í ěëĄ CFU ę°ě´ ę°ěíë 경íĽě´ ëł´ěęł , 3.0, 4.0, 5.0 mg/mL ICG ěŠěĄ ë§ě ëíŹí â
˘-4, 5, 6ęľ°ęłź 3.0, 4.0, 5.0 mg/mLě ICG ěŠěĄě ëíŹě NIR ë¤ě´ě¤ë ë ě´ě 쥰ěŹëĽź í¨ęťí â
Ł-4, 5, 6ęľ°ě ëšęľíě ëë â
Ł-4, 5, 6ęľ°ěě ě˘ ë í° ě¸ęˇ ěě ę°ěę° ę´ě°°ëěë¤. ꡸ëŹë íľęł ě˛ëŚŹ 결곟ěěë ě´ëŹí CFU ę°ě ę°ěë¤ě´ ęľ° ę°ě ě°¨ě´ëĽź ëíë´ě§ë 몝íěë¤.
ě´ě ëí ěě¸ěźëĄ ë ę°ě§ ę°ě¤ě ěę°í´ëłź ě ěë¤. 첍째ë ëě ëëě ICG ěŠěĄěźëĄ ě¸í ě체ě ě°¨í í¨ęłź(Self-shielding) ë돸ě NIR ë¤ě´ě¤ë ë ě´ě ě íŹęłźę° ě´ë ¤ě 윊ëśí íęˇ í¨ęłźëĽź ěťě§ 몝íě ě ěë¤ë ę˛ě´ë¤[
12]. ë째ë ICG ěěŠěĄě ëëę° ëěěëĄ ěě ěąě´ ë ëěě§ëë°, ě´ëĄ ě¸í´ ICGě ëśí´ę° ëśëŚŹí´ě ¸ ICGě ěí ę´ë
ěąě´ í¨ě¨ě ěźëĄ ëíëě§ ëŞťí ě ěë¤ë ę˛ě´ë¤[
17]. ꡸ëźěë ëśęľŹíęł 5.0 mg/mLě ICGě NIR ë¤ě´ě¤ë ë ě´ě 뼟 í¨ęť ěŹěŠí â
Ł-6ęľ°ěě ë쥰꾰ě ëší´ ę°ěĽ í° ě¸ęˇ ěě ę°ěę° ëíë ě ě ëŻ¸ëŁ¨ě´ ëłź ë, ICGě NIR ë¤ě´ě¤ë ë ě´ě 뼟 í¨ęť ěŹěŠí늴 íęˇ í¨ęłźě ěěšě´ ěě ě ěë¤ęł ěśě¸Ąí ě ěë¤.
ëí ICGě NIR ë¤ě´ě¤ë ë ě´ě ě ę´ë°ěě íľí íęˇ í¨ęłźěě ë°ěíë ě´ě ěí ěŁźëł ěĄ°ě§ęłź ěšě§ě ěěě ęł ë ¤í´ěź íë¤ë ě°ë ¤ę° ěë¤. 42.5â ě´ěě ěšě ě¨ëë ěšě 쥰ě§ě ëšę°ěě ě¸ ěěě ě ë°íë¤[
18,
19]. Kreisler ëą[
20]ě ë°ëĽ´ëŠ´ ě쥴 ěěě§ ëęťę° 3.0 mm ěź ë, 809 nmě GaAlAs ë ě´ě 뼟 0.5 - 2.5 Wě ěśë ĽěźëĄ 10 - 120ě´ ę° ěĄ°ěŹíě ë ěšěě ě¨ë ěŚę°ëě 0 - 3.5â ě´ěë¤. ě´ë˛ ě°ęľŹěěë 5.0 mg/mL ICG ěŠěĄě 810 nmě NIR ë¤ě´ě¤ë ë ě´ě 뼟 300 mWě ěśë ĽěźëĄ 30ě´ ę° ěĄ°ěŹíěě ë, ěľë 13.63âě ě¨ë ěěšě´ ę´ě°°ëěë¤. ěŹěŠë ë ě´ě 쥰ěŹëě´ ěšěě í´ëĄě´ ěíĽě ëŻ¸ěš ę°ëĽěąě´ ëŽë¤ë ę˛ě ě§ěí ě ěě§ë§, ꡸ëźěë ëśęľŹíęł í ęłłěźëĄě ě§ě¤ě ě¸ ěĄ°ěŹë ěšě§ě ě¨ë뼟 ěěšěíŹ ě ěë ę°ëĽěąě´ ěěźëŻëĄ ě¤ě ěŹěŠ ěěë ë ě´ě 뼟 ěě§ě´ëŠ´ě ë°ëłľě ěźëĄ 쥰ěŹíë ííę° ěě ěą ëŠ´ěě ë ë°ëě§í ě ěë¤.
ě´ë˛ ě°ęľŹë ěšě ě°ěěŚ ěë°Šě ěí ę´ě ěě ICGě NIR ë¤ě´ě¤ë ë ě´ě ę° S. mutans ě¸ęˇ ë§ě ěľě ě 미ěšë ěíĽě CFU count뼟 íľí´ ě ëě ěźëĄ, CLSMě íľí´ ě ěąě ěźëĄ íę°íë¤ë ě ęłź, ICGě NIR ë¤ě´ě¤ë ë ě´ě ě ěí ě´ ë°ěě 츥ě íěŹ ë°ě´ě´ íęˇ í¨ęłźě 미ěšë ěíĽě íę°í ę˛ě ěěę° ěë¤.
꡸ëŹë ě´ ě°ęľŹë ě¤íě¤ ěĄ°ęą´ěě íěąë S. mutans ě¸ęˇ ë§ě ëí íęˇ ěěŠě íę°íë¤ë ě ěě íęłëĽź ę°ě§ë¤. ęľŹę° ë´ěě ěšě ě°ěěŚě ě ë°íë ě¸ęˇ ë¤ě 미ě돟 ęľ°ë˝ě ě´ëŁ¨ëŠ°, ě¸íŹ ě¸ ę¸°ě§ě ë°ëŹęłź ě ě ě ë°íě ëłí ëąěźëĄ ě¤íě¤ěě ë°°ěí ě¸ęˇ ë§ęłźë ë¤ëĽ¸ íšěąě ę°ě§ë¤. ě´ëĄ ě¸í´ ICGě NIR ë¤ě´ě¤ë ë ě´ě ě ěí íęˇ í¨ęłźě ë í° ě íěąě ę°ě§ ě ěë¤.
ë°ëźě ěě 쥰깴ěě ICGě NIR ë¤ě´ě¤ë ë ě´ě ě í¨ęłźëĽź íę°í기 ěí ěśę°ě ě¸ ě°ęľŹę° íěí늰, ěśę°ě ěźëĄ ě´ëŹí ę´ë°ěě ěí íęˇ í¨ęłźě 기ě ě ëŞ
ííę˛ ë°íë ę˛ě´ í¨ęłźě ě¸ ëŻ¸ě돟 ě 깰뼟 ěí´ íěí ě ěë¤. ëí ICGě NIR ë¤ě´ě¤ë ë ě´ě 뼟 ě´ěŠí ę´ë°ěě ěěě ěźëĄ ěŹěŠí기 ěí´ěë ICGě ëë ë° ě ěŠ ěę°ęłź NIR ë¤ě´ě¤ë ë ě´ě ě ěśë Ľ, ěĄ°ěŹ ěę° ë° ěĄ°ěŹ ęą°ëŚŹ ëąě íŹí¨íë ě íí íëĄí ě˝ě 꾏ěąí기 ěí ěśę°ě ě°ęľŹę° íěíë¤.












 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print