인공타액오염이 유치 상아질에서 3종 상아질 접착제의 결합 강도에 미치는 영향
Effects of Artificial Saliva Contamination on the Bond Strength of Three Dentin Adhesives to Dentin of Primary Teeth
Article information
Abstract
본 연구의 목적은 유치 상아질의 복합레진 술식에서 각 단계별로 치면에 인공타액이 오염되었을 때와 이것을 제거하는 방법이 한 단계 자가부식 접착제와 두 단계 산 부식 접착제의 결합강도에 미치는 영향을 비교 분석하는 것이다.
연구 목적을 달성하기 위해, 건전한 유구치 42개를 선정하여 세 종류의 상아질 접착제인 Scotchbond Universal Adhesive(SBU), All-Bond Universal(ABU)과 Prime & Bond NT(PNT)에 따라 3개의 군으로 분류하였다. 이를 다시 각 접착제에서 7개의 하위 그룹으로 나누었다. 대조군인 1군을 제외한 나머지 군은 인공타액으로 오염시킨 군으로 다음과 같이 분류하였다: 2, 3군 - 접착제 도포 전; 4, 5군 - 접착제 중합 전; 6, 7군 - 접착제 중합 후. 인공타액은 수세, 건조(2, 4, 6군)와 건조(3, 5, 7군)로 제거하였다. 처치된 치면에 복합레진(Filtek, Z-350)으로 수복하고 시편을 제작한 후 미세인장 결합강도(Microtensile bond strength, MTBS)를 측정하였다. One-way ANOVA와 Tukey HSD test를 이용해서 통계분석을 실시하였다(p < 0.05).
대조군에서 MTBS의 평균값은 PNT가 ABU와 SBU에 비해 높게 나타났다(p < 0.001). 세 가지 접착제의 각 오염단계에서 수세와 건조를 시행했을 때(2, 4, 6군)가 건조만 시행했을 때(3, 5, 7군)보다 높은 결합강도를 나타내었다. 그리고 접착제 중합 전 단계에서 인공타액의 오염이 발생했을 때(4, 5군)는 대조군에 비해 낮은 MTBS를 보였다(p < 0.001).
전반적으로 두 단계 산 부식 접착제가 한 단계 자가부식 접착제에 비해 높은 MTBS를 보였다. 접착제를 중합하기 전 단계에서 인공타액에 오염되었을 경우에는 접착 강도가 현저히 감소하였고, 수세와 건조 과정으로 접착강도를 회복할 수 없었다.
Trans Abstract
The aim of this study was to evaluate the effectiveness of artificial saliva contamination and decontamination procedures at different stages of a bonding procedure on the microtensile bond strength (MTBS) of two one-step self-etch adhesives and a two-step total-etch adhesive to dentin of primary teeth.
Forty-two extracted sound primary molars were randomly divided into three groups depending on three adhesives, Scotchbond Universal Adhesive (SBU), All-Bond Universal (ABU) and Prime & Bond NT (PNT). For each adhesive, the teeth were allocated into seven groups. Except for control group, group 1, the groups were contaminated with artificial saliva at three different stages: the groups 2 and 3 - before adhesive application; the groups 4 and 5 - before adhesive polymerization; the groups 6 and 7 - after adhesive polymerization. Decontaminating procedures were rinsing, air-drying (group 2, 4, 6) and air-drying (group 3, 5, 7). The specimens were restored with composite resin (Filtek, Z350) and microtensile bond strength was measured. The data was analyzed with one-way ANOVA and Tukey HSD test (p < 0.05).
In the control group, using PNT resulted in significantly higher bond strength than when ABU and SBU were used (p < 0.001). For three adhesives, the groups 2, 4 and 6 had greater bond strength than the groups 3, 5 and 7. Also, when the artificial saliva was contaminated before adhesive polymerization (group 4, 5), it showed a significantly lower bond strength.
Generally the two-step total-etch adhesive generated a higher bond strength than the one-step self-etch adhesive. Artificial saliva contamination before adhesive polymerization led to a drastic decrease in bond strength, and rinsing with water followed by air-drying could not recover the bond strength.
Ⅰ. 서 론
최근 심미성의 요구가 증가함에 따라 유치에서도 복합레진을 이용하는 수복 치료가 보편화되어있다[1,2]. 상아질 접착제를 이용하는 복합레진수복은 그 술식 과정에서 술자에 대한 의존도가 높고 타액이나 출혈과 같은 수분에 매우 취약하다. 따라서 러버댐을 사용하여 수분을 격리하는 과정이 반드시 필요하다[3]. 그러나 이러한 노력에도 불구하고 타액이 많은 하악구치부 레진수복이나 2급 레진 술식시에 타액 등의 구강액에 노출될 확률이 매우 높다. 게다가 소아치과에서는 치경부까지 확장된 다발성 우식이나 부분 맹출하여 클램프 장착이 어려운 영구치의 우식을 치료하는 경우가 많으며, 이런 경우에는 오염원 조절에 어려움을 겪는다[4]. 전통적 상아질 접착 시스템은 술식 과정이 여러 단계로 이루어져 있기 때문에 단계마다 수분에 노출될 가능성을 내포하고 있다. 이러한 수분 오염은 복합레진과 상아질 간 결합 강도를 감소시키는 주요 원인이며, 접착 실패는 2차 우식 발생의 위험을 증가시킨다[5].
따라서 술식 과정을 간편하게 해주는 두 단계 산 부식 접착제 또는 두 단계 자가부식 접착제가 개발되었고, 최근 개발된 한 단계 자가부식 접착제(all-in-one adhesive)는 산 부식, 프라이머와 접착 과정을 한 단계로 합쳐 술식 단계를 간소화함으로써 오염원에 노출될 가능성을 감소시켰다. 또한 과수세 또는 과건조되는 위험을 감소시켜 술식 민감도를 줄였으며, 타액에 대한 민감성이 적다고 알려져 있다[6-9].
타액 오염에 대한 상아질 접착제의 접착강도에 대한 연구는 많으나, 그 결과가 일치하지 않고 있다. 여러 연구에서 타액 오염 후 접착 강도가 감소하는 결과를 보고하였으나[6,10-13] 그렇지 않다는 연구 결과들도 있다[7,14-16]. 또한 타액 오염이 일어나는 단계에 따라 접착 강도에 차이가 난다고 보고한 연구도 있었지만[8,11], Johnson 등[17]은 접착제의 다양한 적용 단계에서 타액 오염 시에 비오염 군과 유의할 만한 결합 강도의 차이가 나타나지 않았다는 상반되는 결과를 보고하였다.
타액 오염에 의한 복합레진과 접착제의 접착 강도의 변화에 관한 대부분의 연구가 영구치 또는 우치를 대상으로 하며, 유치에 대한 연구는 거의 없는 실정이다[8,10]. 그러나 유치는 영구치와는 구조와 형태가 다르므로 타액 오염이 접착 강도에 미치는 영향도 다를 수 있다[18]. 또한 소아 환자는 협조도가 부족할 가능성이 높아 타액 오염의 위험이 크다. 이러한 차이를 고려할 때, 타액 오염이 영구치 상아질에 미치는 영향을 유치에 그대로 적용하는 것은 오류의 가능성이 있다. 그리고 술식 단계 중 타액 오염이 나타나는 단계 및 제거 방법에 따른 접착력의 변화에 관한 연구도 미비한 실정이다. 따라서 본 연구의 목적은 유치 상아질의 복합레진 술식에서 각 단계별로 상아질 표면에 인공타액이 오염되었을 때와 이것을 제거하는 방법이 한 단계 자가부식 접착제와 두 단계 산 부식 접착제의 결합강도에 미치는 영향을 비교 분석하는 것이다.
Ⅱ. 연구 재료 및 방법
본 연구는 부산대학교 치과병원 임상연구윤리위원회(Institutional Review Board, IRB)의 승인을 받아 시행되었다(IRB No: IRB PNUDH-2016-001).
1. 연구 재료
6개월 내에 발치된 우식이나 결함 부위가 없는 건전한 유구치 42개를 선정하여 시편 제작 전까지 생리식염수에 넣은 채 4℃에서 냉장 보관하였다. 본 연구에 사용된 3종류의 상아질 접착제는 한 단계 자가부식 접착제인 ScotchbondTM Universal Adhesive(SBU, 3M ESPE, St. Paul, MN, USA), All-Bond UniversalTM(ABU, Bisco Inc., Schaumberg, IL, USA)과 두 단계 산부식 접착제인 Prime & Bond® NT(PNT, De Trey Dentsply, Konstanz, Germany)을 이용하였다. 산 부식을 위해서는 35% 인산 젤(3M ESPE, St. Paul, MN, USA)을 사용하였다(Table 1). 상아질 표면을 오염시키는 타액으로는 인공타액인 Taliva® Solution(Hanlim pharm Co., Korea)을 이용하였으며 그것의 구성 성분은 Table 2와 같다. 복합레진 Z-350(Filtek, 3M ESPE, St. Paul, MN, USA)을 이용하여 수복하였다.
2. 연구 방법
1) 군의 분류와 치아 준비
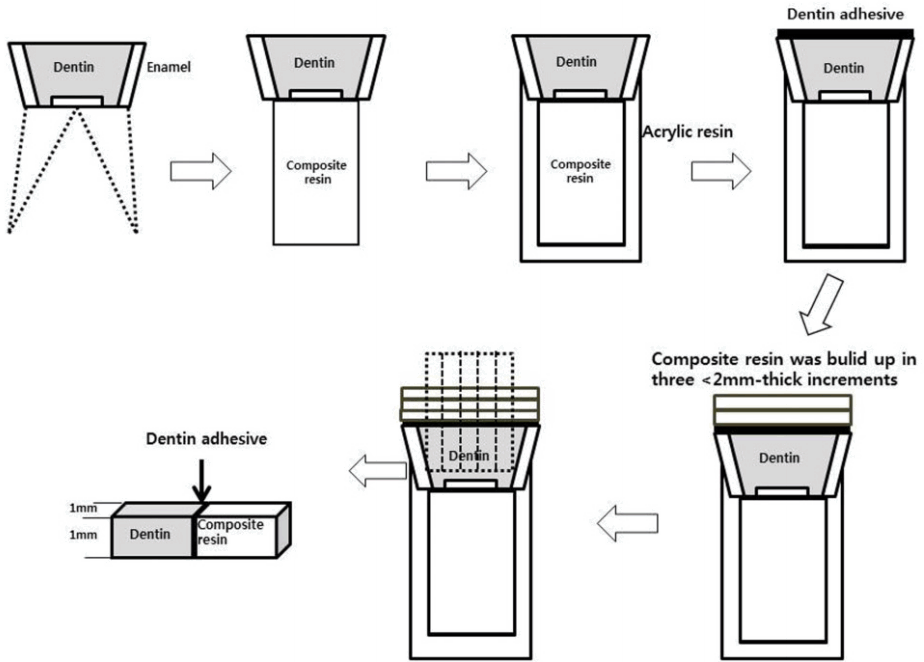
생리식염수에 보관된 치아는 상아질 접착제에 따라 무작위로 SBU군, ABU군, PNT군으로 분류하였다. 각 군은 다시 대조군, 타액 오염 시기(접착제 도포 전, 접착제 중합 전, 접착제 중합 후)와 그 처리 방법(수세와 건조, 건조)에 따라 7개의 하위군으로 나누어 총 21개 군으로 분류하였다. 각 군에 배정된 치아들은 시편 준비과정을 용이하게 하기 위해 치근 부분에 복합레진으로 만든 기둥을 접착하여 자가중합형 레진에 포매하였다. 15×15×10 mm의 몰드에 자가중합형 레진(Tokuso curefast, Tokuyama Dental Corp., Japan)을 채운 후 유구치 치근부분을 아크릴릭 레진에 포매하고 치관부분을 노출시켰다. Model trimmer를 이용하여 주수 하에 치아장축에 수직인 방향으로 교합면 법랑질을 삭제하여 편평한 상아질 표면을 노출시켰다. 이후 #600 SiC 연마지(Buehler Ltd., LAke Bluff, IL, USA)를 이용하여 균일한 표면이 되도록 다듬었다.
2) 상아질 표면 처리 및 레진 접착
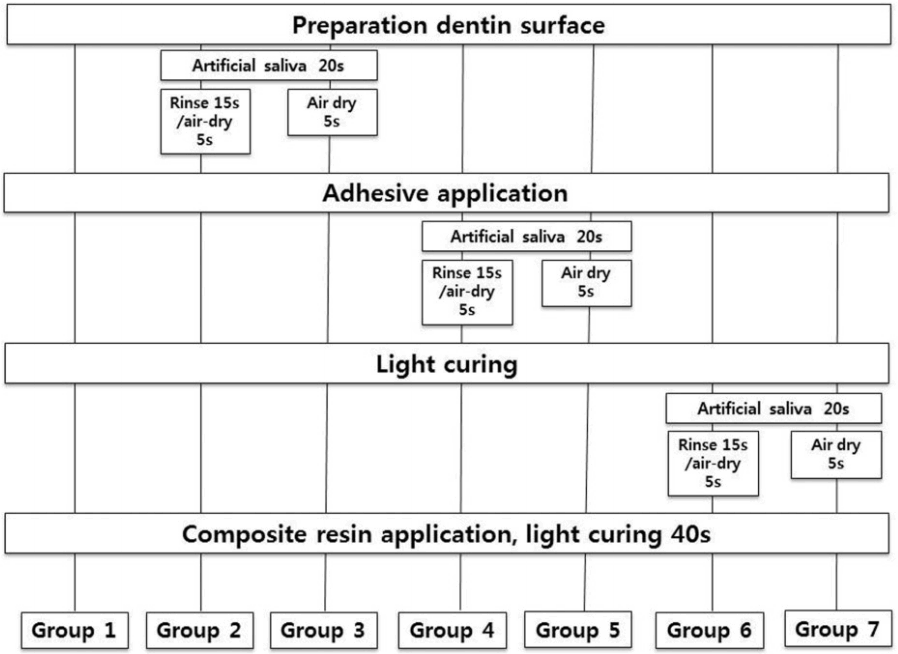
각 군의 치아에는 3종의 상아질 접착제 중 지정된 접착제를 제조사의 지시에 따라 적용하였다. 이때 두 단계 산 부식 접착제인 PNT군으로 분류된 치아는 제조사의 지시에 따라 치면을 35% 인산으로 15초 간 부식하고 10초 간 수세하였다. 그 후 코튼으로 과잉의 수분만 제거해서 상아질이 과건조되지 않도록 하였다. 상아질 면에 인공타액을 오염시키는 시기와 그것을 처리하는 방법에 따라 각 접착제 군 안에서 다시 7개의 군으로 나누고 다음과 같이 처치하였다(Fig. 1).
1군은 대조군으로 젖은 상아질 표면을 3 way syringe를 이용하여 3초 간 공기 건조한 후 제조사의 지시에 따라 접착제를 적용하였다. 광중합한 후 복합레진을 1.5 mm 두께로 3회 적층 충전하고, 각 층마다 40초씩 광중합하여 총 두께가 약 5 mm가 되도록 하였다.
2군은 젖은 상아질 표면을 대조군과 동일한 방법으로 건조시킨 후, 인공타액을 발랐다. 20초 간 기다린 후 15초 동안 물로 세척하고 5초 동안 공기 건조한 후 접착제를 적용하였다. 복합레진은 대조군과 동일한 방법으로 적용하였다. 3군은 2군과 동일한 방법으로 처리하나 오염된 인공타액을 공기 건조만 시켰다.
4군은 대조군과 동일한 방법으로 처리한 후 접착제를 적용하고 인공타액을 발랐다. 20초 간 기다린 후 15초 동안 물로 세척하고 5초 동안 공기 건조시킨 후 10초 간 광중합하였다. 복합레진은 대조군과 동일한 방법으로 적용하였다. 5군은 4군과 동일한 방법으로 처리하나 오염된 인공타액을 공기 건조만 시켰다.
6군은 대조군과 동일한 방법으로 처리한 후 접착제를 적용하고 10초 간 광중합한 후 인공타액을 발랐다. 20초 간 기다린 후 15초 동안 물로 세척하고 5초 동안 공기 중에 건조시켰다. 복합레진은 대조군과 동일한 방법으로 적용하였다. 7군은 6군과 동일한 방법으로 처리하나 오염된 인공타액을 공기 건조만 시켰다.
3) 시편제작
제작된 치아 시편들은 24시간 동안 37℃ 증류수에 보관한 후 저속 다이아몬드 톱(Isomet, Buehler, USA)을 이용하여 주수 하에서 치아 장축을 따라 1 mm 두께로 절단하였다. 이를 다시 수직 절단하여 단면적 약 1 mm2이 되도록 막대형 시편을 제작하였다(Fig. 2). 절단된 시편 중 법랑질이 포함된 것이나 절단 도중 탈락된 시편은 측정에서 제외하여 각 군당 15 - 30개의 시편을 제작하고 결합강도를 측정하기 전까지 증류수에 보관하였다.
4) 미세인장 결합강도(Microtensile bond strength)의 측정
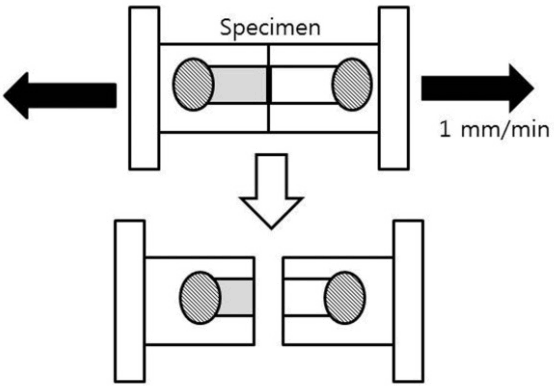
제작된 시편을 Micro Tensile Tester(BISCO Inc., Schaumburgurg, IL, USA)의 tensile zig에 cyanoacrylate (Zapit, Dental Ventures of America Inc., Court, CA, USA)을 이용하여 양끝을 고정시켰다(Fig. 3). 시편을 고정시키는 동안 흼 응력이나 회전력이 가해지지 않도록 주의하였다. 상아질과 복합레진의 접착계면이 파절될 때까지 1.0 mm/min의 속도로 인장하중을 가하고, 접착된 부위가 분리되는 순간의 최대응력을 MPa로 환산하여 미세인장 결합강도(Microtensile bond strength, MTBS)를 측정하였다(Fig. 4).
5) 통계 분석
각 군의 상아질과 복합레진의 미세인장 결합강도에 대한 유의성 검증은 SPSS(ver. 21.0)에서 one-way ANOVA를 이용하여 비교 분석하였다. 사후 검정으로는 Tukey HSD test를 이용하여 p= 0.05 유의수준에서 분석하였다.
Ⅲ. 연구 성적
세 종류 접착제의 치면 처리 방법에 따른 각 군별 미세인장 결합강도를 측정하여 다음과 같은 결과를 얻었다(Table 3). 인공타액을 오염시키지 않은 대조군에서 MTBS의 평균값은 두 단계 산 부식 접착제인 PNT(22.68 ± 6.91 MPa)가 한 단계 자가부식 접착제인 ABU(11.03 ± 8.66 MPa)와 SBU(15.69 ± 9.42 MPa)에 비해 높게 나타났다(p < 0.001). 그리고 인공타액에 오염시킨 군 중 7군을 제외한 나머지 군에서도 PNT가 ABU와 SBU에 비해 전반적으로 높은 결합강도를 보였다. 2, 3, 6군에서는 통계적으로 유의한 차이를 보였으나 4, 5군에서는 유의한 차이가 나타나지 않았다(Fig. 5).

Comparison of the microtensile bond strength between three adhesives at each step.
SBU = Scotchbond Universal, ABU = All-Bond Universal, PNT = Prime & Bond NT. Significant at p < 0.05 level(*)
각 접착제에서 인공타액의 오염 시기와 그 오염원을 제거하는 방법에 따른 MTBS 평균값을 Table 4에 정리하였다. 치면에 오염된 인공타액을 수세와 건조로 제거했을 때(2, 4, 6군)가 건조만 했을 때(3, 5, 7군)보다 높은 MTBS값을 보였다. ABU에서는 2군과 3군에서 유의한 차이를 보였고(p < 0.001), SBU와 PNT에서는 2, 3군과 6, 7군에서 유의한 차이를 보였다(p < 0.05).

Comparison of the microtensile bond strength of three adhesives according to decontamination method after artificial saliva contamination at each step
세 가지 접착제의 접착제 중합 전 단계에 인공타액을 오염시킨 4군과 5군에서는 수세 여부와 관계없이 대조군에 비해 낮은 MTBS를 보였다(p < 0.001). 이 단계에서는 수세와 건조를 시행한 4군과 건조만 시행한 5군의 MTBS 값에서 유의한 차이가 나타나지 않았다(p > 0.05). 그리고 접착제를 바르기 전과 접착제를 중합한 후에 인공타액에 오염된 치면에 수세와 건조를 시행한 2군과 6군의 MTBS는 대조군의 값보다 작았지만 통계적으로 유의한 차이는 나타나지 않았다(p > 0.05).
Ⅳ. 총괄 및 고찰
한 단계 자가부식 접착제는 접착시스템에서 적용 단계를 줄여 적용 시간을 단축하고 술식에 있어서 어려움을 줄일 수 있는 장점이 있다. 그러나 여러 연구에서 레진-상아질 결합의 미세누출이나 결합강도에서 낮은 결과를 보이고 있다[19-21]. 한 단계 자가부식 접착제 사용 시, 인산을 사용할 때보다 얕은 깊이의 부식 양상을 보여주며, 혼성층의 두께도 4세대, 5세대의 상아질 접착제에 비해 얇다[22]. 이러한 혼성층의 두께와 접착력이 직접적인 상관관계가 없다는 연구 결과도 있다[23]. 그러나 Kemp-Scholte 등[24]은 혼성층의 탄성에 의해 복합레진의 수축응력을 흡수할 수 있어 변연 적합도와 수복물의 유지에 도움을 주므로 간접적인 관계가 있음을 시사했다. Deepa 등[12]의 5세대, 6세대, 그리고 7세대 상아질 결합제의 접착강도 비교 실험에서 5세대와 6세대 상아질 접착제의 접착 강도는 유사했으며, 7세대 접착제의 접착 강도가 현저히 낮게 나타났다고 보고하였다. 본 연구의 대조군 그룹에서 두 단계 산 부식 접착제 인 PNT(22.68 ± 6.91 MPa)의 MTBS가 한 단계 자가부식 접착제인 ABU(11.03 ± 8.66 MPa)와 SBU(15.69 ± 9.42 MPa)의 것에 비해 통계적으로 유의하게 높게 나타났으며, ABU와 SBU의 MTBS는 서로 유사하게 나왔다.
복합레진을 이용한 수복 치료의 성공을 좌우하는 요소는 와동 내 수분을 조절하는 것이다[5]. 타액은 다량의 수분(99.4%)과 수종의 단백질로 구성되어 있고, 타액 속 과량의 수분이나 glycoprotein과 같은 물질은 상아질 표면에 부착하거나 상아 세관 내 흡착되어 접착성 수복재의 접착을 방해하는 인자로 작용한다[25,26]. 따라서 접착 시스템의 오염물질에 대한 저항능력이 크게 요구되고 있으며 복합레진수복 술식 중 상아질 표면이 타액에 오염되었을 때 이를 제거하는 방법에 대한 여러 연구들이 이루어졌다[4,7,27-29]. 친수성의 성분을 가진 한 단계 자가부식 접착제는 산 부식 접착제에 비해 타액 오염에 덜 민감하다고 알려져 있다[30,31]. 그러나 접착제 구성 성분에 따라 타액 오염에 영향을 받는 정도가 다르며 타액 오염이 발생하는 시기에 따라서도 접착력은 달라진다[7].
여러 연구들에 의하면 치질에 접착제를 도포할 때 타액 오염이 발생하면 이를 재부식, 세척 및 건조 또는 전체의 접착과정을 반복하는 방법 등을 이용하여 제거하는 것을 추천하고 있다[4,7,27-29]. 접착 시스템의 적용 단계에 따른 타액 오염이 접착 강도에 동일한 영향을 미치는 것은 아니다. 따라서 본 연구에서는 타액이 오염되는 시기를 접착제 적용 과정에 따라 구분하였고, 그것을 수세/건조와 건조를 통해 제거하여 결합강도를 측정하였다. 추가적인 산 부식이나 접착제 재도포를 이용하지 않고 건조, 수세/건조 방법만으로 인공타액을 제거하여 접착제의 결합강도를 회복할 수 있는지를 알아보고자 하였다.
본 연구에서는 각 접착제를 적용하는 과정 중 타액 오염이 발생할 수 있는 단계를 세 가지(접착제 도포 전, 접착제 중합 전, 접착제 중합 후)로 설정하였다. 그리고 각 단계에서 인공타액이 오염되었을 때 그것을 제거하는 방법(수세와 건조, 건조)에 따라 MTBS를 평가하였다. 세 종류의 접착제에서 인공타액의 오염이 미치는 영향은 비슷한 형태로 나타났다. 모든 접착제에서 접착제를 도포하기 전에 상아질이 인공타액에 오염되었을 때, 수세와 건조를 시행한 2군이 건조만 시행한 3군에 비해 높은 MTBS 값을 보였다. 각 접착제의 2군의 MTBS 수치는 대조군의 수치에 비해 20 - 25% 정도 낮기는 했지만 유의한 차이는 보이지 않았다(p > 0.05). 한 단계 자가부식 접착제는 약산으로 상아질 표면(pH 6.9)을 탈회시키게 되는데, 타액에 오염되면 pH가 증가하고 이것은 상아질의 탈회를 방해하여 결과적으로 접착력 감소를 일으킨다[29]. 두 단계 산 부식 접착제인 PNT의 경우 산 부식된 치면에 타액이 오염되어 이를 건조하게 되면 수분을 함유하고 있는 콜라겐 층이 붕괴되고, 건조한 단백질 층이 상아질 층에 흡착되면서 결합강도가 감소하게 된다[14,30]. Suryakumari 등[10]의 연구에서도 one-bottle adhesive system의 타액 오염에 대한 영향을 평가하였다. 그들은 접착제 도포 전 타액에 오염시키고 완전 건조, 수세와 건조, 재부식/수세/건조의 방법으로 제거했을 때, 완전히 건조시킨 군에서 가장 낮은 접착강도를 보였으며 수세와 건조만으로도 대조군과 유사한 접착강도를 보인다고 보고하였다.
본 연구에서는 3종 접착제의 도포 후 중합 전 단계에 타액에 오염된 4군(수세와 건조)과 5군(건조)에서 가장 낮은 MTBS를 나타내었으며, 수세와 건조 방법으로도 접착강도를 회복시킬 수 없었다. 4군과 5군의 MTBS 평균값은 대조군의 값보다 약 80% 정도 적은 값을 나타내었다. 이는 다른 접착 단계보다 접착제 중합 전에 인공타액의 오염이 발생하였을 때가 접착제의 결합강도에 더 부정적인 영향을 미칠 수 있다는 여러 연구들의 결과와 일치하는 결과이다[30,31,33,34]. 이는 인공타액 속의 과량의 수분 때문으로, 수분과 접착 레진이 섞이게 되면 중합률에 부정적인 영향을 미치는 것이라고 판단된다. 즉 수분이 증가함에 따라 접착 레진의 중합률이 감소하고 결합강도가 급격히 감소하게 된다. 이는 친수성 분자인 hydroxyethyl methacrylate (HEMA)가 접착층 내부에서 수분을 유지하고 그 속으로 확산되어 중합되는 동안 사슬이 성장하지 못한 결과이다[13]. 공기 건조 방법으로는 HEMA/water 혼합물에서 수분을 제거할 수 없으며 수세와 건조 방법도 효과가 없다[35]. 게다가 타액 속의 단백질이 접착제와 레진 사이의 공중합(copolymerization)을 방해하고 접착층에 공간을 형성하면서 접착강도를 감소시킨다[11]. 따라서 접착제 중합 전 발생한 인공타액 오염은 결합강도의 감소를 야기하며, 수세와 건조 과정으로는 적절한 접착강도로 회복시킬 수 없다.
접착제를 중합한 후에 인공타액에 오염된 상아질 면을 수세와 건조시킨 6군의 평균 MTBS 값은 세 종류의 접착제 모두에서 대조군에 비해 낮은 값을 보였지만 통계학적으로 유의한 차이를 보이지는 않았다(p > 0.05). 그러나 공기 건조로 제거한 7군에 비하여 높은 값을 보였다(SBU, PNT: p < 0.05, ABU: p > 0.05). 접착제 중합 후 타액에 오염된 치면을 수세/건조로 제거했을 때, 대조군과 유사한 결합강도로 회복되는 것을 보여주었다. Eiriksson 등[26]은 레진 계면 사이의 미세인장접착강도에 대한 타액 오염의 영향을 평가한 실험에서 미반응 폴리머가 존재하는 산소억제층(oxygen-inhibited layer)에 타액의 glycoprotein이 흡착하여 접착제와 레진 성분 간의 긴밀한 접촉을 막으면서 공중합을 하게 되고, 이때 타액을 공기로 건조시키게 되면 레진의 접착에 필요한 일정 두께의 산소억제층 일부가 제거되어 접착강도의 감소를 일으킨다고 하였다. Khoroushi 등[28]의 연구에서도 접착제 광중합 후 오염된 타액을 수세 없이 건조만 하였을 때 접착강도가 급격하게 감소하는 것을 보였으며, 이는 중합한 후 타액의 성분이 상아질에 소수성의 막을 형성하기 때문이라고 설명하였다. Kim 등[29]의 연구에서도 접착제를 중합한 후 타액에 오염되었을 때 수세/건조과정으로 접착강도를 회복하여 본 연구와 일치하는 결과를 보였다.
본 연구에서는 실제 사람의 타액은 구성 성분을 표준화하기 어렵기 때문에 인공타액을 사용하였다. 그러나 인공타액이 사람의 타액과 성분차이가 난다는 점과 in vitro 환경에서 실험을 진행함으로 인해 실제적인 구강 내 환경을 완벽하게 재현하지 못한 한계점이 있다. 또한 본 연구과정에서 사용한 치아 시편은 생리적인 탈락 시기에 근접한 치아이다. Dai 등[36]에 따르면 상아질 내의 intratubular collagen은 연령이 증가함에 따라 감소한다고 보고하였다. 이로 인해 상아질의 구성 성분이 실제 환자에게 적용될 때의 상황과는 차이가 있을 수 있으므로 이에 대한 추가적인 연구가 필요할 것으로 사료된다.
본 연구에서는 인공타액에 오염된 상아질 표면을 공기로 건조시키거나 수세한 후 공기로 건조하는 방법을 이용하여 오염원을 제거하였다. 이를 통해 접착제 도포 전과 접착제 중합 후에 발생한 인공타액의 오염은 수세와 건조로 제거하면 대조군과 유사한 결합강도로 회복할 수 있지만, 접착제 중합 전에 인공타액이 오염된 경우에는 수세와 건조를 해도 결합강도를 회복할 수 없다는 것을 알 수 있었다.
유치에서 복합레진수복을 시행할 때, 실제 환자를 치료하는 임상가는 치료시간을 단축하기 위해 두 단계 산 부식, 한 단계 자가부식 접착제를 사용하는 경우가 많다. 그러나 완벽한 수분 격리가 어렵기 때문에 치면에 타액이 오염되는 상황을 맞이하는 경우가 많다. 접착제 도포 전이나 접착제 중합 후에 타액에 오염되었다면 처음 단계로 돌아가지 않고 수세와 건조를 시행하는 것으로 대조군 결합강도의 약 70 - 90% 정도를 회복할 수 있을 것이다. 그러나 접착제 중합 전 단계에서 치면에 타액이 노출되었다면 수세와 건조 과정이 아닌 전체 접착과정을 다시 시행하는 근본적인 처치가 필요할 것이며, 이에 대한 추가적인 연구가 필요할 것으로 사료된다.
Ⅴ. 결 론
본 연구의 목적은 유치 상아질에서 세 가지 접착제의 적용 단계에 따라 인공타액이 오염되었을 때, 이를 제거하는 방법이 접착제의 결합강도에 미치는 영향을 알아보는 것이다. 유구치로 시편을 제작하여 인공타액이 오염되는 시기를 접착제 적용 전, 접착제 중합 전, 접착제 중합 후로 구분하였다. 이를 한 단계 자가부식 접착제인 Scotchbond Universal Adhesive(SBU)와 All-Bond Universal(ABU), 두 단계 산부식 접착제인 Prime & Bond NT(PNT)를 적용하고 복합레진(Filtek, Z-350)을 충전하여 미세인장결합강도(Microtensile bond strength, MTBS)를 측정함으로써 다음과 같은 결론을 얻었다.
인공타액에 오염이 되지 않았을 때와 오염되었을 때, 전반적으로 두 단계 산 부식 접착제가 한 단계 자가부식 접착제에 비해 높은 MTBS를 보였다. 그리고 접착제를 도포하기 전과 접착제를 중합한 단계에서 치면이 인공타액에 오염되었을 때, 수세와 건조로 인공타액을 제거한 경우 대조군과 유사한 MTBS를 보였다. 그러나 접착제를 중합하기 전 단계에서 상아질 표면이 인공타액에 오염되었을 경우에는 수세와 건조 방법으로 결합강도를 회복할 수 없었다.