과잉치 치수유래 줄기세포의 장기 배양 특성
Characteristics of Supernumerary Tooth-derived Pulp Cells during Long-term Culture
Article information
Abstract
이 연구는 과잉치 치수로부터 얻은 세포를 더 이상 증식하지 못한다고 판단될 때까지 계대배양을 시행하면서 초기, 중기, 후기계대의 특성을 비교 분석하였다. 2명의 건강한 6세 남아로부터 3개의 과잉치를 발거하여 치수조직에서 줄기세포를 얻었다. 이를 SNT1(supernumerary tooth 1), SNT2라고 하고, 다른 아이로부터 얻은 과잉치는 SNT3로 명명하였다. SNT1과 SNT2는 똑 같은 시간으로 계대배양 되었고 SNT3은 조금 빠르게 계대배양 되었다. 전체 계대배양의 평균 기간은 3.6 ± 1.1일이었다. 총 23.3 ± 0.6계대까지 배양되었으며, 83일이 소요되었다. 이를 계대를 기준으로 3등분하여 세 군으로 나누었다. I군에서 II군까지 계대배양에 소요된 시간 증가율은 11.90%였으나, II군에서 III군 사이의 증가율은 28.62%로 2.4배가 증가하였다. 22계대까지의 배양기간에 대한 소요 시간을 회귀분석한 결과 y = 0.1169x + 2.25 (r2 = 0.4778)과 y = 0.1169x + 2.0 (r2 = 0.6444)으로 추론되었다.
과잉치 치수유래 줄기세포의 정상 배양은 20계대까지 가능할 것으로 판단되었으며, 후기로 넘어가면 계대배양 시간이 2.4배 증가였다. 후기 계대에서는 세포내 부유물이 증가하였고, 형태도 선형으로 변형되는 양상이 관찰되었다.
Trans Abstract
This study was conducted to investigate the characteristics of subculture times in the early, middle, and late passages by measuring the time under subculture until it was judged that the supernumerary tooth-derived pulp stem cells (sDPSCS) were no longer proliferating. Three supernumerary teeth from two healthy six-years old boys were extracted and stem cells were obtained from the pulp tissue. This was called SNT1 (supernumerary tooth 1), SNT2, and the supernumerary tooth from another child was named SNT3. SNT1 and 2 were subcultured at the same time and SNT3 was subcultured a little faster. The mean time of complete subculture was 3.6 ± 1.1 days. Total passages were cultured up to 23.3 ± 0.6 and took 83 days. These were divided into three groups based on the passage. The increase rate of time taken in subculture between group I and group II was 11.9%, but the rate between group II and group III was 28.6%, which was 2.4 times increased. The time taken between passages during long-term subculture up to 22 passages shows a regressive pattern y = 0.1169x + 2.25 and y = 0.1169x + 2.0. In conclusion, the passage time of SPSCs increased in late passages, and it shows a similar pattern.
Ⅰ. 서 론
줄기세포는 딸세포로 증식하고 여러 기관으로 분화할 수 있는 능력을 가진 세포로 손상된 조직의 재생 등 많은 분야에서 연구가 이루어지고 있다[1,2]. 다양한 조직에서 줄기세포가 발견되었으며 이중 치아와 관련 있는 줄기세포의 공급원으로 사랑니[3], 발치된 유치[4] 그리고 과잉치[5]가 있다.
치아에서도 얻을 수 있는 줄기세포 공급원은 치수[6], 치주인대[7], 치낭[8], 치근낭[9] 등이다. 각각은 서로 조금씩 다른 특징을 가지고 있으며, 그 중 치수 조직은 경계가 명확하여 혼합되지 않고 비교적 많은 양의 조직을 얻을 수 있다. 줄기세포를 치료 영역에서 이용하려면 많은 양의 세포가 필요하게 된다. 하지만, 세포 공여부의 손상이 필수적인 상황에서 많은 세포를 얻기 위한 방법의 연구가 필요하다[10].
Hayflick[11]은 일부 세포를 제외한 대부분의 세포들은 분열의 한계를 가지고 또한 채취 당시의 나이가 많은 영향을 준다고 하였다. 과잉치는 어린 나이에 제거되고 치아의 형태가 온전하며 치수강의 오염 없이 줄기세포를 얻을 수 있는 좋은 요건을 가지고 있다. 계대배양은 적은 수의 세포를 증식시켜 분화능을 잃지 않으면서 다수의 세포를 확보할 수 있는 방법이다. 그러나 계대가 증가할수록 증식능과 분화능은 변할 수 있다[12,13].
이번 연구의 목적은 과잉치를 계대배양하면서 각 계대를 넘기는 동안 소요되는 시간을 측정하여 증식능의 변화를 예측하고 활용 가능성이 있는 계대의 한계를 예측해보는 것이다.
Ⅱ. 연구대상 및 방법
1. 연구 대상
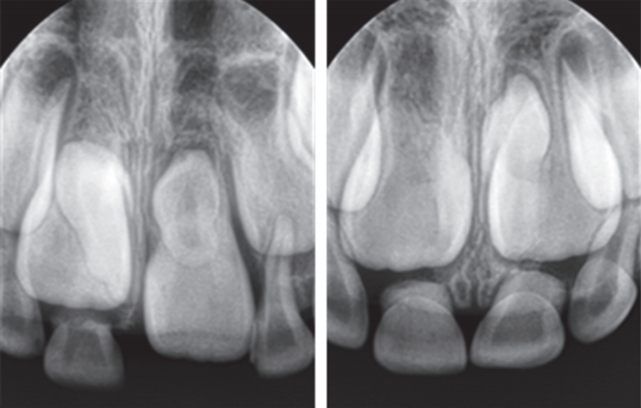
이 연구는 단국대학교 치과대학 소아치과에 내원한 전신질환 및 의과 병력이 없는 만 6세 환아에서 발치한 과잉치 3개를 대상하였다. 2명의 환아로부터 3개의 과잉치를 얻었다. 한 환아에게서 2개의 과잉치를 얻었고(Fig. 1), 이를 SNT1 (supernumerary tooth 1), SNT2 (supernumerary tooth 2)라고 하고, 다른 환아로부터 얻은 과잉치는 SNT3 (supernumerary tooth 3)으로 명명하였다. 두 환아에서 치열 상 비슷한 발육정도를 보였으며 과잉치는 역위되어 있었다. 발치는 소아치과의 숙련된 1명의 술자에 의해 시행되었다.
발치한 과잉치는 발치 즉시 fetal bovine serum 20% (FBS; Gibco, Life Technologies Corporation, Carlsbad, Calif., USA)를 함유한 α-minimum essential medium (α-MEM; Gibco BRL, Grand Island, NY, USA)에 보관하였다. 감염의 위험을 막기 위해 penicillin 100 U/mL와 streptomycin 100 μg/mL (Gibco BRL)을 첨가하였다.
2. 세포의 분리 및 배양
발치한 과잉치에서 치수세포를 추출하는 과정은 모두 멸균된 상황에서 진행하였다. 먼저 다이아몬드 디스크 버(diamond disc bur)를 이용하여 고속으로 백악법랑경계(cementoenamel junction) 하방을 치수가 노출되지 않을 정도로 절삭하였다. 이때 열에 의한 세포의 변성을 막기 위해 phosphate-buffered saline을 주수하면서 시행하였다. 절삭 후 핀셋을 이용하여 치관부와 치근부를 분리하였다. 노출된 치수는 파일 및 barbed broach를 이용하여 발수하였다. 얻어진 치수세포를 enzyme digestion 법을 이용하여 primary culture하였다. No. 15 blade를 이용하여 1 mm3 이하로 소분하였다. 이후 3 mg/mL의 type I collagenase (Sigma-Aldrich Co., St. Louis, MO, USA)와 4 mg/mL의 dispase (Sigma-Aldrich Co., St. Louis, MO, USA)가 들어있는 conical tube에 넣고 37℃ shacking incubator에 1시간 동안 보관하여 반응이 일어나도록 하였다. 다음은 20% FBS (Gibco, Life Technologies Corporation, Carlsbad, Calif., USA)을 첨가한 α-MEM (Gibco BRL, Grand Island, NY, USA) 배지에 넣은 후 37℃, 5% CO2의 습윤 항온기에서 배양하였다. 계대배양을 위해 다음 계대로 넘어가는 기준은 배지의 70 - 80% confluence를 보일 때로 하였다. Trypsin-EDTA (ethylene diamine tetraacetic acid; CORNING Inc., NY, USA)로 배양 접시에서 세포를 분리시킨 후 1/4씩 나누어 계대배양하였다. 이를 0계대라 칭하였다. 같은 방법으로 세포가 더 이상 계대배양을 할 수 없다고 판단될 때까지 계대배양을 시행하였으며 계대마다 계대배양을 하는데 걸린 시간을 기록하였다.
Ⅲ. 연구 성적
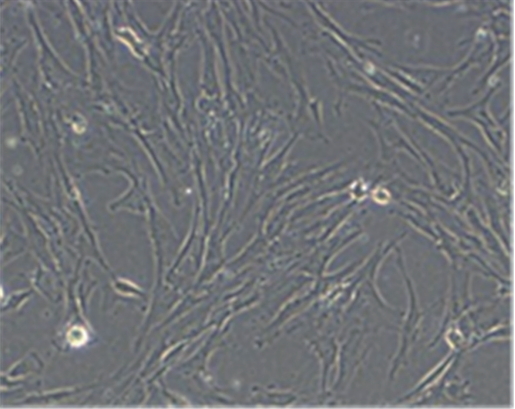
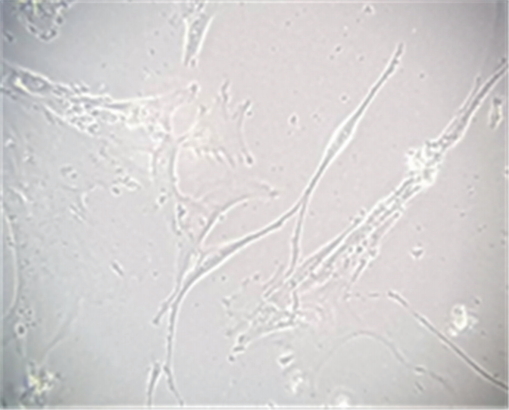
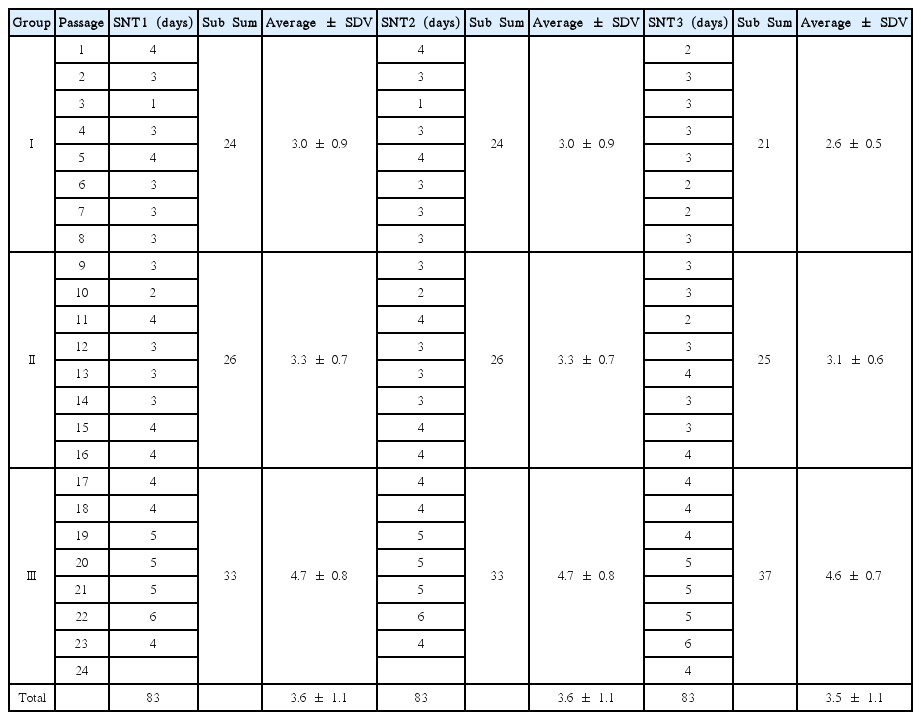
동일인에서 얻은 SNT1과 SNT2는 23계대까지 배양할 수 있었으며, SNT3은 24계대까지 배양할 수 있었다. 이 시점에 이르러 세포의 형태는 넓어지고, 세포내 과립이 증가하고 부유물이 많아졌다(Fig. 2, 3). 이 시기를 계대배양을 멈춘 시점으로 하였고 이 시기까지 소요된 시간은 Table 1에 나타내었다.
계대배양을 종료 시점까지 평균 23.3 ± 0.6 계대였으며, 세포의 생주기 정도에 따라 초기, 중기, 그리고 후기로 나누어 1계대부터 8계대 까지를 I군, 9계대부터 16계대 까지를 II군 그리고 17계대부터 24계대 까지를 III군으로 하였다.
각 군에서 소요된 계대배양 시간과 이를 추세 그래프로 나타낸 것이다(Fig. 4, Table 2). SNT1과 SNT2는 계대 간에 소요된 시간이 모든 계대에서 동일하였다. 그러나 SNT3은 SNT1과 SNT2에 비해 빨랐다. 전체 계대배양에 소요된 시간은 모두 83일이었다. 그러나 SNT1과 SNT2는 23계대까지 배양했고, SNT3는 24계대까지 배양했다. 따라서 SNT3가 23계대까지 배양한 시간은 79일로 SNT1, SNT2보다 4일이 짧았다. 이를 세분해서 보면 처음 I군에서 시간이 SNT3이 SNT1과 SNT2보다 3일이 빨랐고, II군에서는 1일이 적게 소요되었으며 III군에서는 동일한 시간이 소요되었다.

Subculture time spent in each group. (SNT1 = supernumerary tooth 1; SNT2 = supernumerary tooth 2; SNT3 = supernumerary tooth 3)
이를 통해 III군에서 세포의 성장이 느려지는 것으로 판단할 수 있었다. 세 개의 세포를 배양한 결과 초기 I군에서의 배양 속도가 전체의 속도를 결정할 수 있다는 것을 추론할 수 있었다. 또한, 초기 배양 속도가 빠른 경우, 좀 더 오랫동안 배양이 가능할 수 있음도 유추할 수 있었다.
I군과 II군 사이의 변화율은 SNT1과 SNT2는 8.33%인 반면 SNT3은 19.05% 였다. II군과 III군 사이 변화율은 SNT1과 SNT2에서는 26.92%인데, SNT3은 32%였다. 이를 통해 처음 I군에서의 배양시간의 차이는 III군으로 갈수록 줄어드는 양상임을 유추할 수 있다. 또한 III군에서는 모든 세포들의 성장 속도가 늦어진다는 것을 알 수 있다.
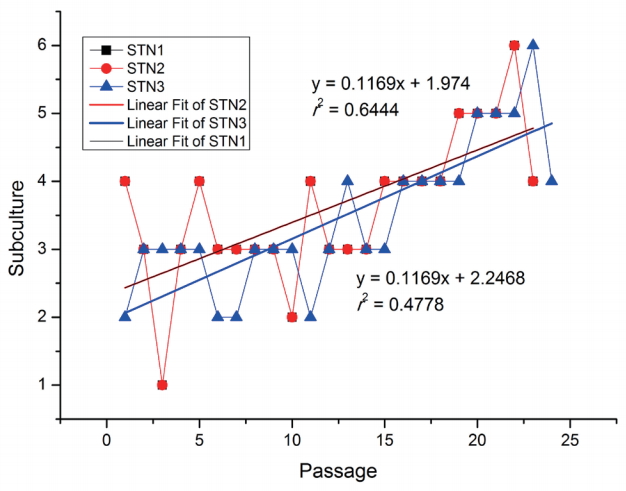
SNT1과 SNT2의 22계대 동안 각 계대 사이에 소요된 시간을 그래프로 그려보면 y = 0.1169x + 2.2468로 회귀되는 양상이었다. r2값은 0.4778이었다(Fig. 5). SNT3의 22계대 동안 각 계대 사이에 소요된 시간을 그래프로 그려보면 y = 0.1169x + 1.974로 회귀되는 양상이었다. r2값은 0.6444이었다(Fig. 5). 22계대까지 배양한 세 개의 X값의 기울기가 0.1169로 같았다. 이를 통해 서로 다른 세포라 하더라도 계대가 배양될수록 유사한 추세로 배양 시간이 변함을 유추할 수 있었다.
Ⅳ. 총괄 및 고찰
이 연구의 목적은 2명의 6세 남아로부터 얻은 3개의 과잉치를 이용하여 과잉치가 더 이상 증식하지 못한다고 판단될 때까지 계대배양을 시행하면서 그 시간을 측정하여 초기, 중기, 후기 계대의 배양시간의 특성을 연구해 보는 것이었다.
모든 과잉치는 역위되어 있었고 원뿔형(conical type)이었다. 과잉치의 형태에 따른 계대배양 시간에 관한 이전의 연구에서 원뿔형 과잉치는 10계대까지 배양하는데 평균 2.9 ± 0.3일, 총 29일이 소요되었다[14]. 이번 연구에서는 23.3 ± 0.6 계대까지 배양하였으며, 83일이 소요되었다. 10계대까지 배양하는데 걸린 시간은 2.8 ± 0.8일로 이전의 연구와 유사한 결과를 보였다. 이를 통해 대부분의 과잉치는 유사한 계대배양 시간의 특성을 가짐을 유추할 수 있었다.
SNT1과 SNT2는 전체 계대배양 동안 동일한 계대배양 시간을 보였고, SNT3는 조금 빠른 계대배양 시간을 보였다. 이런 특성을 구분하기 위해 보다 많은 자료의 연구가 필요하다고 판단된다.
3개의 SNT의 22계대 동안 각 계대 사이에 소요된 시간을 그래프로 그려보면 y = 0.1169x + 2.25과 y = 0.1169x + 2.0으로 회귀되는 양상이었다. 이는 이전에 16계대까지 관찰하여 각 계대 사이에 소요된 시간을 연구한 y = 0.1118x + 1.8과 유사한 결과였다[15].
Bone marrow-derived mesenchymal stem cells (BMMSCs)을 이용한 연구에서 80% confluence에서 계대배양을 할 경우 세포 형태는 서로 연결된 형태(morphology)를 나타내었다[16]. 그리고 BMMSCs가 50% and 100% confluence때보다 70% and 80% confluence에서 population doubling (PD)의 유의한 증가가 관찰되었다[16]. 이를 바탕으로 이번 연구에서도 70 - 80% confluence를 이루는 시점을 다음 계대로 계대배양하는 기준으로 하였다. 각 계대로 계대배양을 할 때 세포의 1/4을 분주하여 다음 계대로 배양하였으므로 각 계대사이의 PD는 2가 된다.
Human mesenchymal stem cells (hMSCs)을 이용한 연구에서 처음 세포를 배양하여 첫 계대로 계대배양 하는데 primary culture에서 PD의 횟수는 거의 11번이었다[13]. 이 후의 계대 간의 계대배양 동안은 2 PD였으며 전체 계대배양 동안 누적 PD는 38 ± 4였다[1]. 이를 통해 유추해 볼 때 이번 연구는 23.3 ± 0.6계대까지 배양되었으므로 누적 PD는 57.7 ± 1.2라고 할 수 있다. 실험 대상의 연령이 어린 것이 PD가 증가한 주요 인자라고 할 수 있다.
Hayflick[11]은 인간 섬유아세포를 이용한 실험에서 어떠한 조건에서 배양하더라도 세포는 50여회의 분열 한계를 가지며 이를 “Hayflick Limit”라고 하였다. 그는 태아(embryonic)에서 채취한 섬유아세포는 약 70여회, 성인(adult tissues)에서 추출한 경우는 30 - 40회, 그리고 70대 노인의 경우는 20회 정도 분열 후 정지된다고 보고하였다. PD를 통해 생물학적 나이(biological age)를 유추한 이전의 연구를 볼 때 과잉치에서 얻은 세포의 PD가 57회 정도인 것은 태아와 성인의 중간에 위치한다는 가설과 일치한다. 줄기세포의 공급원에서 제공자의 나이가 증가함에 따라 줄기세포의 수 및 증식 능력이 감소하며[17] 임상적 목적이라는 관점에서 고유한 특성을 가진 많은 줄기세포를 얻는다는 것은 아주 중요한 요소이다.
BMMSCs를 이용한 연구에서 20% confluence에 이르는데 소요된 시간은 2 - 3일이지만 80% confluence에 도달하는 데는 2 - 3주가 소요되었다[16]. 사랑니의 치수에서 유래한 세포의 계대배양 시간은 5 - 7일 정도가 소요되었고[18], 이에 반해 과잉치를 이용한 이번 연구에서는 3.6 ± 1.1일이었다. 이를 통해 과잉치는 훌륭한 줄기세포 공급원의 요소를 가진다고 볼 수 있다.
탯줄유래 줄기세포는 총 20번의 계대배양 중 세포의 형태는 7번째 계대배양 이후 세포질이 넓어지고 세포의 크기가 커지는 변화를 나타냈으며 population doubling time(PDT)가 증가하기 시작하였고 평균 10번의 계대배양 후 노화(senescence)를 나타냈다[19]. 이번 연구에서 3계대와 23계대의 세포 형태를 비교할 때 20계대까지도 세포의 형태는 유사하게 유지되었으며 23계대가 되어서 세포질이 넓어지는 특징을 보였다.
계대배양을 거듭할수록 증식능과 분화능은 감소하는 것이 일반적 견해였으나[13], Human embryonic stem cells (hESCs)은 장기간 계대배양을 하거나 냉동보관(cryopreservation)을 해도 고유의 특성을 유지한다[20,21]. 최근 연구에서는 이와는 달리 계대배양이 증가할수록 증식능력은 증가하지만, 분화능력은 감소하였다는 보고도 있다[12].
미분화 세포를 체외 장기 배양함으로 인해 염색체 이상이 발생할 수도 있다[22]. 계대배양 시간이 4일 이상 증가할 경우 자가발생적 분화가 증가할 수 있다[10]. 따라서, 계대배양 시간을 줄일 수 있다면 오염 및 변이의 가능성을 줄일 수 있는 중요한 인자가 된다. 이번 연구에서 이용한 3개의 SNT는 83일간 배양되었고 계대는 23.3 ± 0.6이었다. 이를 3개의 군으로 나누어 처음 8계대까지를 I군, 다음 16계대까지를 II군, 그리고 마지막 계대까지를 III군으로 나누어 각각을 초기 계대(early passage), 중기 계대(middle passage), 후기 계대(late passage)로 구분하였다.
I군에서 II군으로 갈 때 계대배양에 소요된 시간의 증가율은 11.9%였으나, II군에서 III군 사이의 증가율은 28.6%로 2.4배가 증가하였다. 이는 탯줄유래 줄기세포를 10계대까지 계대배양하면서 계대배양에 따른 PDT을 조사한 연구에서 7계대 시기부터 증가하였다는 연구와 일치된다[19]. 또한 지방유래 줄기세포의 경우 총 10번의 계대배양 중 6계대부터 PDT가 증가하였다는 연구와도 합치하였다[23]. 그리고 MSC를 이용한 장기간의 계대배양 연구에서는 118일 동안 배양되었고 이때의 계대는 9계대가 평균이었다[23]. 이에 반해 과잉치를 이용한 이번 연구의 결과를 통해 충분한 세포를 확보할 수 있는 가능성을 제시한다.
이상을 종합해 볼 때, 과잉치 치수로부터 얻은 줄기세포는 각 계대 사이에 계대배양에 소요된 시간이 3일 전후이며 16계대까지의 배양 동안에도 배양시간은 유지되는 것으로 볼 때 이는 자가발생적 분화 가능성을 줄이고 배양액의 교환 시기를 고려하여도 경제적이고 효율적인 배양이 가능하다고 할 수 있다. 그러나 계대배양 시간만으로 세포의 특성을 파악하는 것은 한계가 있으므로 검증을 위한 추가적인 연구가 필요하다고 사료되었다.
Ⅴ. 결 론
2명의 건강한 6세 남아의 과잉치 3개를 발치하여 치수세포로부터 줄기세포를 얻어 계대배양하였다. 이 중 동일인으로부터 얻은 2개의 과잉치 치수유래 줄기세포는 23계대까지, 다른 하나는 24계대까지 배양되었다. 이 시점에 이르러 세포의 형태는 넓어지고, 세포내 과립이 증가하고 부유물이 많아졌다.
전체 계대배양의 평균 시간은 3.6 ± 1.1일이었다. 총 계대를 3개의 군으로 나누었으며, I군에서 II군으로 갈 때 계대배양에 소요된 시간의 증가율은 11.9%였으나, II군에서 III군 사이의 증가율은 28.6%로 2.4배가 증가하였다.
3개의 SNT의 22계대 동안 각 계대 사이에 소요된 시간을 그래프로 그려보면 y = 0.1169x + 2.25과 y = 0.1169x + 2.0으로 회귀되는 양상이었다.