Indocyanine Green을 이용한 광열 치료의 다종 우식원성 바이오필름에 대한 효과
Effect of Photothermal Therapy with Indocyanine Green in Multispecies Biofilm
Article information
Abstract
이 연구의 목적은 indocyanine green (ICG)과 근적외선 diode 레이저의 사용이 다종 우식원성 바이오필름에 미치는 항균 효과를 조사하는 것이다.
Streptococcus mutans, Lactobacillus casei, Candida albicans를 포함하는 다종 바이오필름이 ICG와 808 nm 근적외선 diode 레이저를 사용하여 서로 다른 조사 시간에 따라 처리되었다. Colony-forming unit (CFU)을 측정하였고, 바이오필름의 정성적 평가를 위해 공초점 레이저 주사 현미경(Confocal laser scanning microscopy, CLSM) 관찰을 시행하였다. 또한 광열 치료의 효과를 평가하기 위해 온도 측정이 시행되었다.
ICG와 근적외선 diode 레이저를 사용한 군에서 CFU의 감소량이 통계적으로 유의하였으나, L. casei와 C. albicans에서는 시간에 따른 항균 효과의 유의한 차이는 관찰되지 않았다. CLSM 관찰에서도 유사한 세균 감소를 확인할 수 있었다. ICG와 근적외선 diode 레이저를 사용한 군은 ICG 없이 광조사를 시행한 군보다 더 높은 온도 상승을 보였으며, 측정된 온도는 열 치료의 온도 범위와 유사하였다.
결론적으로, ICG와 근적외선 diode 레이저는 다종 우식원성 바이오필름에 항균 효과를 보였다. 우식 예방을 위한 보조 수단으로 사용될 가능성을 가지나, 임상적인 적용을 위해서는 적용 프로토콜에 관한 연구가 필요하다.
Trans Abstract
The purpose of this study is to investigate the antibacterial effects of indocyanine green (ICG) and near-infrared diode lasers on multispecies biofilms.
Multispecies biofilms of Streptococcus mutans, Lactobacillus casei and Candida albicans were treated with different irradiation time using photosensitizer ICG and 808 nm near-infrared diode laser. Colony forming unit (CFU) was measured, and qualitative evaluation of biofilm was performed with confocal laser scanning microscopy (CLSM). Temperature measurement was conducted to evaluate photothermal effect.
In the groups using ICG and diode laser, reduction in CFU was statistically significant, but the difference in antibacterial effect on L. casei and C. albicans with irradiation time was not significant, and similar results were confirmed with CLSM. Groups with ICG and diode laser showed higher temperature elevation than groups without ICG, and results of measured temperature were similar to the range of hyperthermia.
In conclusion, ICG and near-infrared diode laser showed antibacterial effects on multispecies biofilms, but studies on protocol are necessary for clinical application.
Ⅰ. 서 론
광역동 치료(Photodynamic therapy, PDT)는 특정한 빛에 의해 활성화된 광감각제에서 발생하는 자유 라디칼이나 활성 산소(Reactive oxygen species, ROS)가 세포 내의 단백질이나 DNA의 괴사를 통해 세포 사멸 효과를 나타내며[1], 광감각제와 광원이 적용된 부위에만 선택적으로 항균 작용을 나타낸다는 점과 반복적인 사용에도 내성이 발생하지 않는 장점을 가진다[2]. Erythrosine, toluidine blue O (TBO), methylene blue (MB), eosin, rose bengal 등 PDT를 위한 여러 광감각제가 있으나, 최근 indocyanine green (ICG)이 새로운 광감각제로 제시되었다[3]. 600 - 900 nm 범위의 파장을 가지는 빛을 흡수하며, 혈액에 용해되었을 때 대략 800 nm의 파장에서 가장 높은 흡수율을 보인다[4]. ICG는 유일하게 미국 Food and Drug Administration (FDA) 승인을 받은 근적외선 염료(Near-infrared dye)로, 안과 영역의 조영술이나 심박출량 측정을 위한 혈관 조영제, 간기능 검사 등에 사용되는 재료이나 적절한 광원과 함께 사용하면 세포 독성을 나타낸다[5]. 광원이 조사된 ICG는 형광 방출, 활성 산소의 발생, 열 변환의 3가지 반응 경로를 보이며, 이 중 약 85%의 흡수된 빛 에너지가 열로 전환된다. ICG의 광반응에서 발생하는 열에 의한 효과는 일반적인 PDT의 기전과 다르므로 광열 치료(Photothermal therapy, PTT)로 분류된다[5].
ICG의 치과 영역에서의 사용은 치주 질환, 치아 우식에 대한 효과가 연구되고 있다[6,7]. 그 중 치아 우식은 다원성 질병으로 여러 원인 요소가 존재하고, 우식원성 미생물이 큰 비중을 차지하며 Streptococcus mutans와 Lactobacillus 종이 우식의 발생과 진행에 각각 주요한 역할을 한다[8,9]. 또한 최근 Candida albicans와 DMF score 사이의 높은 관련성이 보고되어 치아 우식의 원인 세균일 가능성이 제시되었으며[10], 특히 유아기 우식증(Early childhood caries, ECC)을 가진 소아의 치태나 상아질에서 높은 C. albicans의 비율이 관찰되어 ECC와의 높은 연관성을 갖는 것으로 알려져 있다[11].
Fekrazed 등[12]은 ICG와 810 nm 근적외선 diode 레이저를 이용하였을 때 S. mutans에 대한 유의한 살균 효과를 가지며 이는 MB를 이용한 PDT보다 효과적이라고 보고하였다. 또한 Ahrari 등[13]은 부유상태의 Lactobacillus 종에 적용하여 세균 수의 유의한 감소를 보고하였으며, Azizi 등[14]은 C. albicans에 대한 항균 효과를 MB를 이용한 PDT, chlorhexidine, nystatin 등과 함께 비교하였고 ICG와 808 nm diode 레이저의 PDT와 nystatin의 사용이 다른 처리보다 유의하게 우수한 항균 효과를 나타냄을 보고했다.
앞선 연구에서 여러 세균에 대한 ICG와 근적외선 레이저의 효과는 보고되었으나 이는 대부분 부유 상태(planktonic)의 세균이나 바이오필름(biofilm) 상태의 단일 균주에 대한 효과만 평가하였다. 실제 임상에서의 우식원성 세균은 다종으로 이루어진 바이오필름 상태로 존재하며 단일 균주에 보이는 효과와 다를 수 있으나, 그에 대한 연구는 보고된 바 없다.
이번 연구의 목적은 ICG와 근적외선 diode 레이저가 ECC와 관련된 S. mutans , Lactobacillus 종, C. albicans를 포함하는 다종 우식원성 바이오필름에 미치는 효과를 실험실 조건에서 양적(quantitative), 정성적(qualitative)으로 평가하고, 온도 변화를 평가하여 PTT의 효과를 알아보는 것이다.
Ⅱ. 연구 재료 및 방법
1. 세균 배양
S. mutans ATCC 25175, L. casei ATCC 334, C. albicans KCTC 7270 표준 균주를 Brain Heart Infusion (BHI; Becton, Dickinson and Company, Sparks, MD, USA) broth에 5% CO2, 37℃ 조건에서 18시간 각각 배양하였다. 각 세균 배양액의 혼탁도는 분광 광도계(Smart Plus 2700; Young-woo Inst., Seoul, Korea)를 이용하여 측정하였다. S. mutans와 L. casei는 접종을 위해 BHI broth를 이용하여 1 × 109 colony-forming unit (CFU)/mL로, C. albicans는 2 × 109 CFU/mL로 희석하였다.
2. 바이오필름 형성
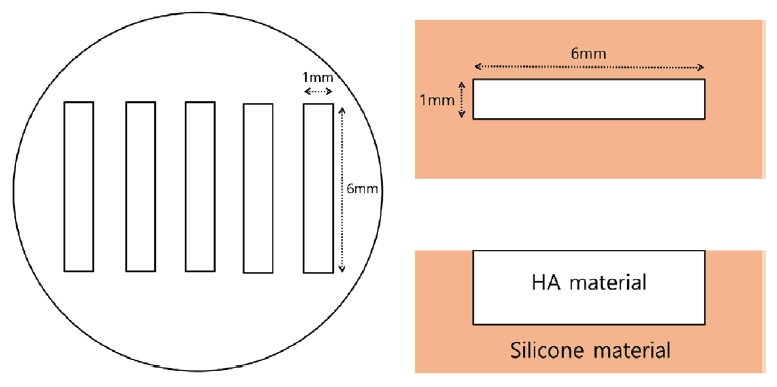
다종 우식원성 바이오필름 형성을 위해 원형의 hydroxyapatite (HA) disk (BioSurface Technologies Corporation, Bozeman, MT, USA, diameter 1.27 cm)를 광원의 크기에 맞는 6.0 mm × 1.0 mm 직사각형 형태로 잘라서 사용하였다. HA 시편의 옆면과 뒷면은 Silicone (Examixfine injection type, GC Corporation, Tokyo, Japan)이 적용되었다(Fig. 1). 준비된 HA 시편은 ethylene oxide gas를 이용하여 소독되었으며 24-well plate에서 1% sucrose를 포함하는 BHI broth 960 μL와 S. mutans와 L. casei의 희석액 각각 20 μL, C. albicans의 희석액 1000 μL를 접종하였다. 각 세균의 최종 접종 농도는 S. mutans와 L. casei가 1 × 107, C. albicans가 1 × 109 CFU/mL였으며 이 농도는 최종적인 세균 수 측정에서 유사한 집락 수를 갖도록 pilot study를 통하여 설정되었다.
3. 광감각제와 광원
ICG (Sigma-Aldrich, St. Louis, MO, USA) 분말을 멸균 증류수(Sterile distilled water)에 용해시켜 2 mg/mL의 농도로 실험 직전에 제작하여 암실에 보관하였다. 광원은 근적외선 diode 레이저(808MD-300-1245, Laserland, Besram Technology Incorporation, Hengelo, Netherlands)를 1 cm 거리에서 광조사 하였으며 출력(808 nm, 300 mW)은 광도계(DigiRate LM-100; Monitex, New Taipei City, Taiwan)를 이용하여 확인하였다.
4. 바이오필름 처치
모든 well에서 배지를 제거 후, 멸균증류수에 희석시킨 2 mg/mL의 ICG 용액 20 μL를 바이오필름이 형성된 시편에 적용하여 5분 간 암실에서 보관하였다. 광원 조사는 각각 10초, 30초, 60초 시행되었으며 실험군은 Table 1과 같이 설정하였다.
5. Colony-forming unit 측정
인산완충생리식염수(phosphate-buffered saline, PBS)를 이용하여 세척되었고 각 시편을 초음파 처리(VC 100; Sonics & Materials Inc., Danbury, CT, USA)하여 세균을 탈락시켰다. 이후 PBS로 희석하여 혈액 한천 배지(Blood agar plate)에 50 μL씩 도말하여 5% CO2, 37℃ 조건에서 72시간 배양하였고, 배양된 각 세균의 수는 맨눈으로 측정하였으며 3가지 균의 서로 다른 형태를 통하여 구분하였다. 측정된 각 세균의 수는 Log CFU 값으로 변환하여 사용되었다.
6. 공초점 레이저 주사 현미경 관찰
광감각제 및 광원 처리 후 다종 우식원성 바이오필름의 정성적(qualitative) 평가를 위해 공초점 레이저 주사 현미경(Confocal laser scanning microscopy, CLSM) 관찰을 사용하였다. 각 실험 방법에 따라 처리된 시편은 세척 후 200 μL의 LIVE/DEAD BacLight Bacterial Viability Kit Solution (Molecular Probes, Inc., Eugene, OR, USA)를 이용하여 제조사의 지시에 따라 상온의 암실에서 15분 간 염색되었다. LEICA TCS SP8 (Leica Microsystem, Wetzlar, Germany)을 이용하여 10배 배율로 바이오필름을 관찰하였다.
7. 바이오필름 표면 온도 측정
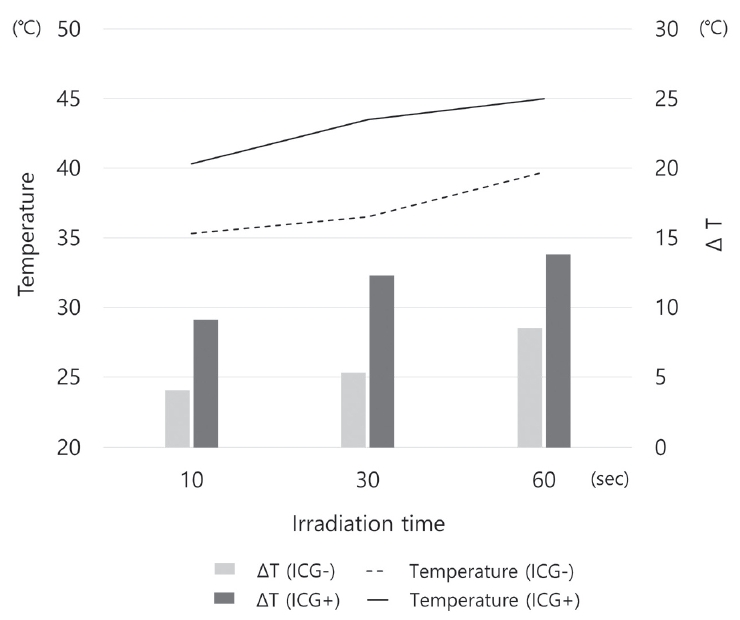
ICG와 근적외선 diode 레이저에 의한 온도 변화를 평가하기 위해 광조사를 시행하는 Ⅲ - Ⅷ군에 대해 1채널 열전대 온도계(thermocouple thermometer; Testo 295, Testo, Lenzkirch, Germany)와 열전대(K type thermocouple; 2ABAc, 2.0 mm diameter/1.0 m length, Thermocoax, France)를 이용하여 바이오필름 표면 온도를 측정하였다. 바이오필름을 형성하여 배지를 제거한 후 37℃ 배양기에 보관하여 동일한 초기 온도로 설정하였으며, 3회 측정하여 평균값을 통해 결과를 비교하였다.
8. 통계 분석
통계 분석을 위해 SPSS version 22 (SPSS Inc, Chicago, IL, USA)가 사용되었다. 각 처리 방법에 따른 항균 효과를 비교하기 위해, 측정된 CFU 값을 Kruskal-Wallis test로 통계적 유의성을 분석하였고, Bonferroni test 사후 분석을 이용하였다.
Ⅲ. 연구 성적
1. Colony-forming unit 측정
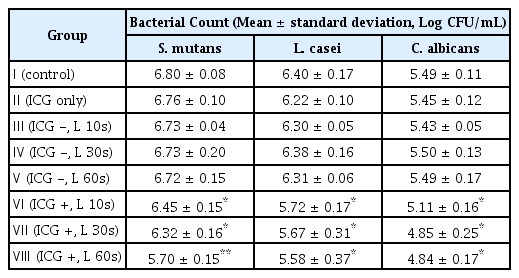
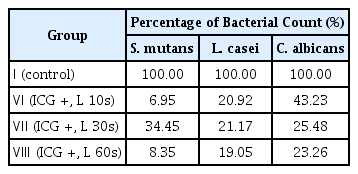
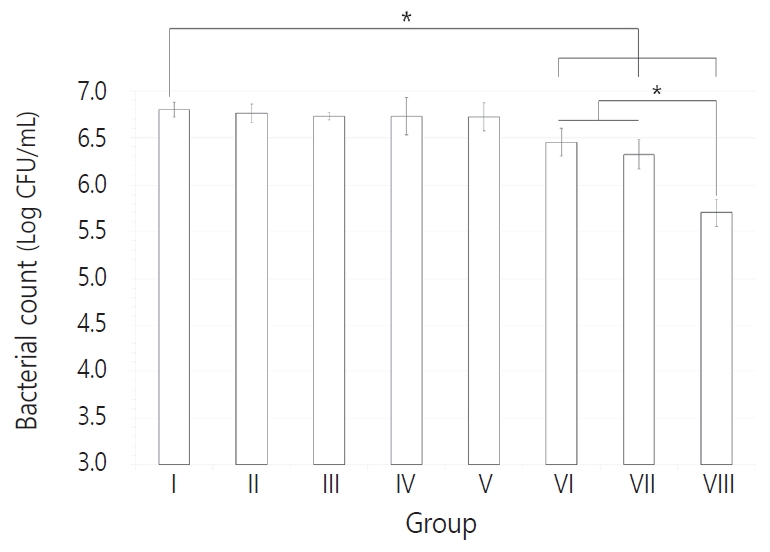
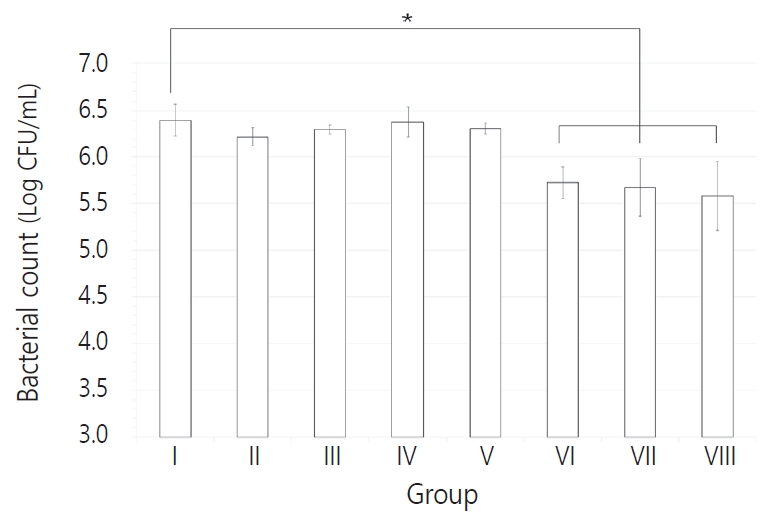
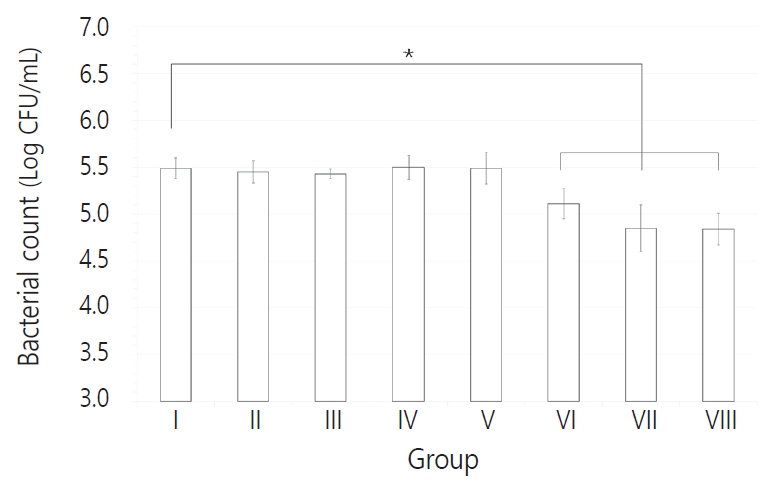
다종 우식원성 바이오필름에 포함된 각 세균의 CFU 결과를 Table 2 - 5에 정리하였다. ICG와 diode 레이저를 적용한 Ⅵ - Ⅷ군에서 세 균 모두 CFU 값이 감소하는 양상을 보였다(p < 0.05). Table 6에서 대조군에 대한 Ⅵ, Ⅶ, Ⅷ군의 Log CFU 결과를 비율로 나타내었으며 조사 시간이 길어짐에 따라 더 많은 세균 감소 비율을 보였고, 가장 높은 세균 감소는 S. mutans에서 관찰되었다. S. mutans의 경우 각각 10초와 30초를 적용한 Ⅵ, Ⅶ군과 60초를 적용한 Ⅷ군 간 CFU 값의 유의한 차이를 보였으나, L. casei와 C. albicans는 광조사 시간을 달리한 Ⅵ - Ⅷ군 간 통계적 유의성은 관찰되지 않았다(Fig. 2-4).
2. 공초점 레이저 주사 현미경 관찰
CLSM 관찰에서 초록색 형광은 살아있는 세균, 붉은색 형광은 죽은 세균을 나타낸다[15]. ICG와 diode 레이저를 여러 조건으로 처리한 Ⅰ - Ⅷ군의 항균 효과를 시각적으로 관찰할 수 있다(Fig. 5). CLSM으로 촬영한 바이오필름의 살아있는 세포와 죽어있는 세포의 colocalization 분석을 Pearson’s correlation analysis를 시행하여 pixel distribution diagram인 산점도(scatter plot)로 그래프화 하였다(Fig. 6)[16]. Log CFU 분석에서 유의한 차이를 보이지 않았던 Ⅰ - Ⅴ군은 유사하게 대부분 초록색 형광을 띄며, 살아있는 세포로 주로 구성되어 있다. 반면 ICG와 근적외선 diode 레이저를 사용한 Ⅵ - Ⅷ군은 붉은색 형광의 죽은 세균의 비율이 늘어난 것을 확인할 수 있고, Ⅵ군보다도 Ⅶ, Ⅷ군에서 더 높은 붉은색 형광의 비율이 관찰된다.
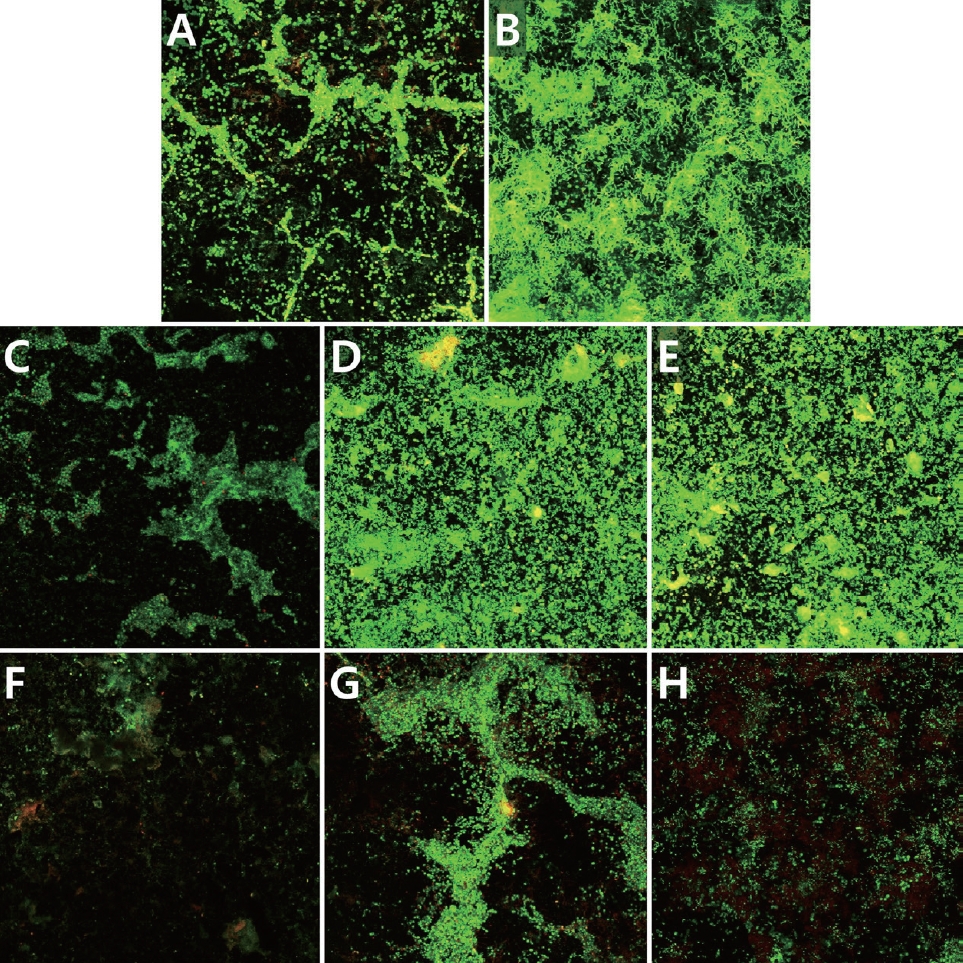
Confocal laser scanning microscopy images of Live/Dead cells in in-vitro cariogenic multispecies biofilm. (A) Group Ⅰ (control), (B) Group Ⅱ (ICG only), (C) Group Ⅲ (ICG-, L 10s), (D) Group Ⅳ (ICG-, L 30s), (E) Group Ⅴ (ICG- , L 60s), (F) Group Ⅵ (ICG+, L 10s), (G) Group Ⅶ (ICG+, L 30s), (H) Group Ⅷ (ICG+, L 60s).
3. 바이오필름 표면 온도 측정
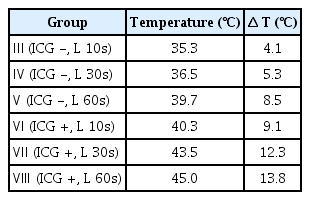
ICG와 근적외선 diode 레이저 조사 조건에 따른 바이오필름의 표면 온도를 측정하였다. 모든 시편들의 초기 온도는 동일하게 설정되었고 31.2℃로 측정되었다. 광조사를 시행한 Ⅲ - Ⅷ군에 대해 각각 표면 온도 및 온도 변화량을 Table 7에 정리하였고 그래프화 하였다(Fig. 7). ICG 없이 광조사한 Ⅲ - Ⅴ군보다 ICG와 함께 광조사를 시행한 Ⅵ - Ⅷ군은 모두 상대적으로 온도가 높았으며, 평균 약 5.77℃ 높은 온도 상승을 보였다. ICG 없이 60초 광조사한 Ⅴ군보다도 ICG와 함께 10초 광조사한 Ⅵ군의 온도가 더 높았고, 가장 높은 온도 변화는 Ⅷ군에서 13.8℃ 상승하여 45℃로 측정되었다.
Ⅳ. 총괄 및 고찰
PDT를 적용할 때 광원은 광감각제를 활성화시킬 수 있는 파장 영역이어야 한다. 여러 조합의 광원과 광감각제가 연구되고 있으나 대부분 가시광선 영역의 광원이 사용되고 있다[17]. 이번 연구에서 사용된 근적외선 영역의 808 nm 파장을 갖는 diode 레이저는 높은 투과율을 가지며, ICG와 함께 이용되어 항균 목적으로 적용될 경우 깊은 부위의 치아 조직이나 상아세관까지 효과를 낼 수 있다는 장점을 갖는다[18].
이 연구의 결과에서 ICG와 함께 광원을 10초, 30초, 60초를 각각 적용한 모든 군에서 세균 수의 감소를 보였다(p < 0.05). 그 중 S. mutans에 대해서는 10초, 30초와 60초 간에도 통계적으로 유의한 차이가 나타났으며, L. casei와 C. albicans는 조사 시간에 따른 유의성은 나타나지 않았으나 CFU값은 감소하는 경향성을 보였다.
그러나 가장 항균 효과가 높았던 Ⅷ군에서의 CFU 값의 감소량은 S. mutans , L. casei , C. albicans 각각 약 1.10, 0.82, 0.65 Log CFU/mL로 이는 S. mutans , Lactobacillus종, C. albicans의 부유 상태의 단일 균주에 대해 각각 1.39, 1.10, 1.20 Log CFU/mL의 감소를 보고하였던 이전의 연구들보다 낮은 수치였다[12-14]. 앞선 연구들은 9 J 또는 10 J의 에너지를 사용했고, 이번 연구의 Ⅷ군에서는 더 높은 에너지량인 18 J을 사용하였지만 절대적인 세균 감소 수는 더 적었다.
이에 대해 첫째, 이전의 연구들은 부유 상태의 세균에 대해 진행된 연구인 반면 이번 연구에서는 인공 바이오필름을 형성하여 실험을 진행하였다. 바이오필름 상태의 세균은 구조적으로 미생물들에 의해 생성된 glycoprotein과 polysaccharide의 matrix 에 의해 캡슐화(encapsulated)되어있는 상태로 존재하며[19], 부유 상태의 세균에 비해 성장 속도, 활성화 정도, 유전자 발현 등 여러 가지 면에서 다르다고 알려져 있다[20,21]. 이런 바이오필름 상태의 세균은 부유 상태의 세균보다 항균 물질이나 숙주의 면역체계에 대한 저항성이 높고, 이는 PDT의 효과에도 낮은 감수성을 갖는다[22]. 둘째, 단일 세균으로 존재할 때 보다 다종 세균으로 이루어진 바이오필름의 경우 단일 세균의 바이오필름에 비해 두꺼운 두께와 구조의 복잡성 및 세균 간의 상호작용 때문에 항균 작용을 나타내는 치료에 저항성이 높다[23]. Teixeira 등[24]은 TBO와 적색 LED를 이용한 PDT가 다종 세균의 바이오필름에 대해, 단일 세균의 바이오필름에 적용되었을 때 보다 낮은 항균 효과를 보고했고, Müller 등[25]의 연구에서 S. mutans , C. albicans를 포함하는 6종류의 세균으로 이루어진 다종 세균 바이오필름에 대해 단일 세균의 바이오필름에는 유의한 효과를 보였던 조건의 MB와 soft laser를 이용한 PDT가 세균 수의 감소에 있어서 유의한 효과를 나타내지 못했으며, 이 연구들은 이번 연구의 결과와 유사했다.
또한 L. casei와 C. albicans에 대해 조사 시간에 따라 유의한 차이가 발생하지 않은 결과에 대해서, 이전 Pereira 등[26]은 다종 세균 바이오필름에 대한 PDT 후 주사전자현미경(scanning electron microscopy)을 이용하여 분석한 결과 PDT의 세포 사멸 효과가 바이오필름의 표면에서 주로 일어난다고 하였고, O’Neill 등[27]은 CLSM을 이용한 연구에서 유사한 결과를 확인하였다. 이번 연구에서도 다종 세균의 바이오필름의 두께로 인해 광감각제인 ICG 희석액의 충분한 침투가 이루어지지 않아 광조사 시간이 증가했음에도 불구하고 유의한 효과 차이가 나타나지 않은 것으로 추측된다. 반면 이번 연구에서 S. mutans는 10초, 30초 광조사한 군에 비해 60초 광조사한 군에서 더 많은 세균 수의 감소를 보였다(p < 0.05). Soria-Lozano 등[28]은 여러 종류의 세균에 대해 여러 광감각제를 이용한 PDT의 효과를 조사한 결과, 광감각제의 종류에 따라 각 세균에 대한 PDT의 효능이 상이하다고 하였고, 이번 연구의 결과를 토대로 ICG와 근적외선 diode 레이저가 S. mutans에 대한 효능이 L. casei와 C. albicans에 비해 상대적으로 높다고 추측할 수 있으나 이것을 명확히 하기 위해서는 추가적인 연구가 필요하다.
마찬가지로, CLSM 관찰에서도 ICG와 근적외선 diode 레이저를 함께 적용한 Ⅵ - Ⅷ군에서 사멸된 세포를 나타내는 붉은색 형광의 눈에 띄는 증가가 관찰되었지만 살아있는 세균인 초록색 형광의 비율도 높은 것을 산점도 그래프를 통해 확인할 수 있고(Fig. 6), 이는 이번 연구의 조건에서는 항균 효과가 다소 부족한 것으로 판단할 수 있다.
실제 구강 내에서의 다종 우식원성 세균으로 이루어진 바이오필름은 실험실 조건과는 상이하며, 이는 PDT를 적용할 때 적절한 사용 조건을 설정하는데 어려움을 준다[29]. 이 연구의 결과를 토대로, 더 많은 광원 에너지량이나 더 높은 광감각제의 농도, 적용 시간 등에 관한 실험실 및 생체내 연구가 필요하며, 이번 연구에서 사용된 조건에서 세균 수의 감소를 보였으나 American society of Microbiology에서 제시하는 항균력을 나타내는 수치인 3 Log CFU/mL에는 미치지 못하므로[30], 충분한 항균 효과를 낼 수 있는 적정 조건을 찾는 것이 실제 임상적인 사용을 위해 필수적이다.
열 치료(hyperthermia)는 이전부터 의과 영역에서 이용되어 왔으며, 종양 세포가 정상 세포보다 온도 상승에 민감하므로 암 치료에 좋은 효과를 갖는다[31]. 열 치료의 온도 범위는 약 40 - 43℃ 사이이며 42℃는 암세포의 사멸에 충분하지만 정상 세포에는 유해한 작용이 없다고 알려져 있는데, 이는 정상 세포와 다른 암세포의 pH와 낮은 산소 수준, 단백질 변성 등에 의한 차이로 인해 나타난다[32]. 또한 대부분의 정상 조직은 44℃ 이하에서 30분보다 짧게 적용되는 열 치료에서 손상이 발생하지 않는다고 보고된다[5]. 이번 연구에서 근적외선 diode 레이저의 광조사는, ICG를 포함하지 않은 Ⅲ - Ⅴ군보다 ICG를 포함한 Ⅵ - Ⅷ 군에서 세균 수가 더 많이 감소하였고, 상대적으로 더 높은 열 발생량을 보였으며, 각각 40.3, 43.5, 45℃까지 상승하는 것을 확인할 수 있었다. 이번 연구에서 사용된 조건에서 측정된 온도가 열 치료의 범위와 유사하며, 이를 통해 ICG와 근적외선 diode 레이저가 PTT의 효과가 있다고 판단할 수 있다.
Ⅴ. 결 론
ECC와 연관된 S. mutans , L. casei , C. albicans를 포함하는 다종 우식원성 바이오필름에 대한 ICG와 근적외선 diode 레이저의 효과를 평가하였고, 3가지 균 모두에서 항균 효과를 보였다. 이를 통해 실제 임상의 다종 세균으로 이루어진 바이오필름에도 우식 예방을 위한 보조 수단으로 사용될 수 있는 가능성을 제시한다.