|
 |
| J Korean Acad Pediatr Dent > Volume 46(3); 2019 > Article |
|
초록
이 연구의 목적은 항암 치료를 받은 후 소아환자에서 나타나는 치아의 발육장애의 유병률에 대해 조사하고, 항암 치료의 시기, 치료 방법, 그리고 치료 기간에 따라 어떤 차이를 보이는 지 알아보고자 하였다.
임상 및 방사선학적 기록이 존재하는 93명의 소아암 환자에 대해 치아의 수, 치아의 형태, 치근의 형태, 치아의 발달 정도를 평가하였다.
조사된 치아의 형성장애는 전체 환자의 61.3%에서 발견되었고, 이중에는 치근의 형태이상이 31.2%로 가장 많이 관찰되었다. 6세 이후에 항암치료를 시작한 환아보다 6세 이전에 항암 치료를 시작한 환아에서 결손치(p = 0.029)와 왜소치(p = 0.003) 수가 더 많았으며, 이는 통계적으로 유의한 차이를 나타냈다. 화학요법과 방사선요법을 병행한 경우 화학요법만을 시행한 경우보다 결손치(p = 0.030), 왜소치(p = 0.046), 그리고 치근형태이상(p = 0.009)이 더 높은 빈도로 관찰되었고, 이는 통계적으로 유의한 차이를 나타냈다. 18개월 미만의 항암 치료 기간을 경험한 환아에 비해 18개월 이상 항암 치료를 받은 환아에서 결손치(p = 0.032), 왜소치(p = 0.011), 치근형태이상(p = 0.025), 그리고 총 치아이상(p = 0.036)의 수가 더 많았으며, 이는 통계적으로 유의한 차이를 나타냈다.
결론적으로, 항암치료를 받은 소아환자에서 더 빠른 항암치료 개시시기, 화학 및 방사선 요법의 병행, 그리고 더 긴 항암치료 기간이 치아 형성 중의 이상소견을 증가시켰다.
Abstract
The purpose of this study was to examine dental complications and to evaluate the effects of initial treatment age, treatment modalities, and treatment duration on the disorder after radiation and chemotherapy in pediatric cancer patients.
For 93 children with clinical and radiographic data, the number of teeth, the morphology of teeth, the shape of the roots, and development status of the dentition were evaluated.
Dental development disorders were found in 61.3% of the children. The mostly found abnormality was root deformity with the prevalence of 31.2%. In children submitted to the therapy before the age of 6, the number of missing teeth (p = 0.029) and microdontia (p = 0.003) were greater compared to the children who started to receive the treatment after the age of 6. The combination of radiation and chemotherapy showed significantly greater incidences of missing teeth (p = 0.030), microdontia (p = 0.046), and root deformity (p = 0.009) when compared with the sole application of chemotherapy. When the children were submitted to anticancer therapy for 18 months or longer duration, greater number of missing teeth (p = 0.032), microdontia (p = 0.011), root deformity (p = 0.025), and total number of teeth affected (p = 0.036) were observed compared with duration less than 18 months.
The number of dental abnormalities increased when the children were treated at earlier ages, with combination of radiation and chemotherapy, and for longer period of time.
소아에서의 암은 성인에서 발견되는 경우에 비해 전반적으로 더 낮은 유병률을 가지는 것으로 보고되는데, 미국에서 1년간 진단된 160만 명의 환자 중 20세 이하 환자의 비율은 1%에 미치지 않는다고 하였다[1]. 국내에서는 매년 100만 명의 소아 가운데 약 200여 명의 비율로 소아암이 발생된다고 보고되었다[2]. 소아암은 생애 첫 일년간 가장 높은 유병률을 나타내며, 2 - 3세 사이에 두 번째로 높은 유병률을 보인다[3]. 가장 흔히 나타나는 형태로는 급성 백혈병, 림프종, 신경아세포종, 뇌종양, 연조직종양, 그리고 신장 종양 등이 있다[4].
암의 비침습적 치료방법으로는 전신적 치료를 위한 화학요법과 국소적 치료를 위한 방사선요법이 주로 사용되는데, 환자 치료 시 이들을 각각 혹은 병용하여 접근하게 된다[5]. 화학 요법은 알킬화 약물을 사용하여 세포사를 유발하게 되며, 이는 세포 내 핵산의 합성이나 기능에 영향을 미쳐 DNA의 합성 및 복제, RNA 전사, 혹은 세포질 수송 기작을 방해하게 된다. 방사선 요법은 고에너지의 방사선을 통해 세포 내 자유라디칼을 형성, DNA를 손상시켜 세포 증식을 저해한다. 이들의 일반적 조사량은 이환된 암의 유형에 따라 다양하나 대부분 근치적 치료 시 일당 180 - 200 cGy의 분할투여량이 사용되며, 총 50 - 70 Gy로 선량을 한정하게 된다[5].
이러한 항암치료는 암세포를 억제하는 이점을 제공하는 한편, 전신적 및 국소적인 합병증을 초래하게 된다. 화학 요법이나 방사선 요법에 의해 조직에 직접적인 손상이나 전신 독성에 의한 간접적인 손상을 보인다[3]. 전신적으로는 피부의 궤양, 뼈의 괴사, 무력감, 감염에 대한 취약성 등이 나타나며, 치과 영역에서는 구강건조증, 점막염, 타액선염, 치아의 발육 장애 등이 유발될 수 있다[6]. 이러한 구강내 합병증은 급성 및 만성으로 분류할 수 있고, 만성적으로 발생하는 합병증 가운데 치아의 발육 장애는 왜소치, 거대치, 결손치, 법랑질 형성장애, 치근의 형태 변형, 발육지연 등을 포함한다[7].
화학 요법 및 방사선 요법으로 치료를 받은 환자의 구강 조직에 대한 영향으로 환자의 일생에 영향을 미칠 수 있으며, 이러한 변화의 정도는 치아의 조직형성 단계, 치료의 방법, 그리고 방사선 조사량에 의해 결정된다고 보고된 바 있다[7]. 소아암 환자의 항암치료 후 치아에 나타나는 형성장애에 대한 국내의 문헌은 드물며, 기존 문헌에서는 소수의 소아를 대상으로 한 연구만 보고된 실정이다.
이 연구의 목적은 화학 및 방사선요법을 경험한 다수의 소아 환자에서 항암요법의 시기, 치료 방법, 치료 기간이 치아의 발육장애에 미치는 영향에 대해 알아보고자 함이다.
전남대학교 암 전문센터의 치과에 내원한 700명의 소아암 환자 중 선정 기준을 만족하는 93명의 환아를 선정하였다. 선정 기준은 다음과 같다:
선정 기준 : 1. 화학요법이나 방사선 요법을 받은 환아, 2. 12세이전에 항암치료를 개시한 환아, 3. 최소 1년간 항암치료를 받은 환아. 4. 치료 종결 최소 1년 후 해당기관 치과에 내원하여 파노라마 및 치근단 방사선 사진을 촬영한 환자. 5. 종양의 재발로 인한 재치료를 받지 않은 환자.
1인의 판독자가 환아의 파노라마 및 치근단 방사선 사진을 통해 다음의 치아발육 장애를 보이는 이상 징후들을 관찰하였다:
치아의 크기(왜소치), 치아의 수(결손치), 치근의 형태(단근치, 세근치), 치수강의 형태(우상치), 그리고 2년 이상의 발육 지연.
상하악 양측 중절치, 측절치, 견치, 제 1소구치, 제 2소구치, 제 1대구치, 그리고 제 2대구치가 모두 존재할 경우를 정상 기준으로 하여 영구치의 결손을 평가하였다(Fig. 2). 치아 결손에 대해 동일 치아에 대한 가족력이 존재하는 경우 평가대상에서 제외되었다.
치근 형태의 경우 치관과 인접 치아의 치근을 기준으로 평가하였다. 정상의 치근 형태에서 치근첨이 과수렴하거나(세근치) 치근 길이가 실제 치관의 길이와 같거나 짧은 경우(단근치), 치근의 형태이상으로 평가하였다(Fig. 3).
1명의 조사자가 6개월 간격으로 2차례 시행한 자료에 대해 신뢰성 분석을 시행하였고, Kappa 계수는 통계적으로 유의한 일치도를 나타냈다(95% CI 0.967 - 985, p= 0.022).
관찰된 치아 발육 장애를 치료개시 연령, 치료 방법, 그리고 치료 기간에 따라 평가하였다. 치료개시 연령 및 암 종류에 따른 치아 발육 장애에 대해서 카이제곱 검정이 사용되었고, 치료 방법에 따른 치아 발육 장애에 대해서 Fisher 정확성검정을 사용되었다. 통계분석은 Microsoft Windows용 SPSS 20.0(SPSS Inc., USA)을 이용했으며, 모든 통계량의 유의 수준은 0.05로 하였다.
소아암의 종류별로 분포는 급성림프구성 백혈병이 46명(54%)으로 가장 많았고, 그 다음으로는 급성골수성백혈병(12%), 육종(11%), 신경아세포종(9%), 림프종(7%), 수모세포종(5%), 만성골수성 백혈병(2%)이 뒤를 이었다(Table 1).
연령대 별로 소아암 환자의 진단 및 치료 시기의 평균 연령은 6.2세였으며, 1세는 1명, 2세는 6명, 3세는 8명, 4세는 10명, 5세는 8명, 6세는 14명, 7세는 21명, 8세는 11명, 9세는 4명, 10세는 4명, 11세는 6명으로, 7세의 환아가 가장 많았다. 전 연령대에서 가장 많이 관찰된 진단명 또한 급성림프구성 백혈병이었다(Table 2).
치료 방법으로는 화학요법만을 시행한 환아가 74명으로 전체의 79.6%를 차지했고, 화학요법과 방사선 요법을 병행한 환아는 19명으로 전체의 20.4%를 차지했다(Table 3).
치료 기간으로는 18개월 이내로 시행한 환아가 47명으로 전체의 50.5%를 차지했고, 18개월 이상 항암치료를 받은 환아는 46명으로 전체의 49.5%를 차지했다(Table 4).
조사된 치아의 형성장애는 전체 환자의 61.3%에서 발견되었고, 이중에는 치근의 형태이상이 31.2%로 가장 많이 관찰되었다. 그 다음으로 왜소치, 발달 지연, 상실치, 우상치가 각각 29.0%, 21.5%, 14.0% 그리고 4.3%의 환아에서 발견되었다(Table 5).
6세 이후에 항암치료를 시작한 환아보다 6세 이전에 항암 치료를 시작한 환아에서 결손치(p= 0.029)와 왜소치(p= 0.003) 수가 더 많았으며, 이는 통계적으로 유의한 차이를 나타냈다(Table 6).
급성백혈병의 경우 대부분의 환자에서 화학요법만을 시행하였고, 림프종과 만성백혈병, 골육종의 경우 모든 환아에서 화학요법만이 사용되었다. 수모세포종의 경우, 4명의 환자 모두에게 화학요법과 방사선 요법을 동반한 치료가 시행되었고, Wilm’s tumor 환자 3명 모두 복합치료를 받았다. 신경아세포종 환아의 경우 9명중 4명에게 화학요법이 시행되었고, 5명에게 화학요법과 방사선요법이 함께 시행되었다. 화학 요법만을 받은 환아와 화학 요법과 방사선 요법을 복합적으로 받은 환아에서 결손치는 각각 10.8%와 31.6%의 빈도를 나타냈으며, 왜소치의 경우 각각 27.0%와 36.8%, 그리고 치근형태이상의 경우 25.7%와 52.6%의 빈도를 나타냈다. 화학요법과 방사선요법을 병행한 경우 결손치(p= 0.030), 왜소치(p= 0.046), 그리고 치근형태이상(p= 0.009)이 더 높은 빈도로 관찰되었고, 이는 통계적으로 유의한 차이를 나타냈다(Table 7).
18개월 미만의 항암 치료 기간을 가진 환아에 비해 18개월 이상 항암 치료를 받은 환아에서 결손치(p= 0.032), 왜소치(p= 0.011), 치근형태이상(p= 0.025), 그리고 총 치아 발육 장애(p= 0.036)의 빈도가 더 많았으며, 이는 통계적으로 유의한 차이를 나타냈다(Table 8).
한국 통계청의 2015년 보고에 의하면 한국 소아 중 암환자는 6,305명이었다. 이들의 연령별 분포는 5세 미만, 5세에서 9세, 10세에서 14세, 그리고 15세에서 19세에 각각 1,221명, 1,505명, 1,279명, 그리고 2,300명으로 15세에서 19세가 가장 높은 비중을 차지했다[2]. 이 연구의 목적은 소아암의 치료를 위해 항암치료를 받은 환아에서 치아의 발육장애에 대해 조사하고, 치료개시 당시 환아의 연령, 종양을 억제하기 위해 사용된 치료 방법, 그리고 항암 치료 기간에 따른 치아 이상의 차이를 평가하는 것이었다.
Proc 등[13]의 연구에서 항암치료를 경험한 아동들이 항암치료를 경험하지 않은 아동들에 비해 유의하게 높은 치아 형성장애를 나타내었다. 그 중, 왜소치(36.06%)가 가장 높은 빈도로 나타났고 결손치(31.14%)가 그 다음으로 빈번히 관찰되었는데, 이들은 대조군에 비해 3배 이상의 높은 비율로 관찰되었다[13]. Lopez 등[7]은 항암치료 이후 나타나는 치아 형성장애 가운데 우상치가 가장 높은 유병률을 나타냈고, 항암치료를 받지 않은 대조군에 비해 유의하게 높은 유병률을 보고하였다. 또한, 5세 이전에 2,200 cGy 이상의 방사선 조사를 받은 경우 가장 높은 치아 형성장애 유병률을 나타낸다고 하였다.
이 연구에서는 항암치료를 경험한 환아의 29.0%에서 왜소치가 관찰되었는데, 이는 Sonis[14]의 연구에서 급성림프구성 백혈병에 대한 치료를 받은 환자 가운데 22.0%에서 왜소치가 관찰되고, Jeong 등[15]의 연구에서 항암 치료를 받지 않은 아이들의 경우 3.0%로 관찰되었던 것과 비교하였을 때, 항암 치료를 받은 경우 왜소치의 발생이 더 증가하는 경향을 확인할 수 있다. 이 연구에서 신경아세포종의 치료를 위해 항암 요법을 받은 환아 중 66.7%에서 왜소치가 발견되었는데, 이는 신경아세포종의 경우 상대적으로 더 어린나이에 치료를 개시하였기 때문일 것이다.
결손치의 경우 환아의 15.0%에서 관찰되었는데, 이는 Nunn 등[16]의 연구에서 급성림프구성 백혈병과 림프종에 대한 치료를 시행한 아이들의 경우와 같은 비율이었으며, Jeong 등[15]은 보통 아이들의 경우 3.6%의 빈도로 나타났다고 하였다. 이 연구에서는 더 어린 시기에 항암요법을 시작한 신경아세포종 환아들에서 33.3%의 높은 유병률을 나타냈다.
치근 형태의 이상은 환아 중 31.2%에서 나타났고, Nunn 등[16]의 연구에서 급성림프구성 백혈병과 림프종에 대한 치료를 시행한 아이들의 경우 27.0%의 유병률을 나타낸 바 있다. 이 연구에서는 신경아세포종으로 인한 항암 요법을 받은 어린이 가운데 66.7%의 치근 형태이상을 보였고, 수모세포종의 경우 50.0%의 환아에서 치근의 형태이상이 나타났다.
이 연구에서는 6세 이전, 항암 치료를 더 일찍 시작한 환아의 경우 그 이후의 나이에 항암치료를 시작한 환아에 결손치와 왜소치가 더 빈번히 발생하였는데, 1세에서 6세까지의 시기는 치아의 형성이 매우 활발하며 영구치의 출은과 제 3대구치의 형성이 개시되는 시기로, 이 시기를 기준으로 항암요법이 치아 및 치근의 형성과정에 미치는 영향을 확인하고자 하였다[3,13]. 기존의 연구에서 영구치의 경조직 형성 시기인 만 3세를 항암치료에 따른 치아 합병증 평가의 기준으로 하였으나, 이 연구에서는 해당 연령대의 환아에 대한 자료가 한정되어 있어 결과를 도출하지 못했다.
Kaste 등[17]은 20 Gy이상의 방사선량을 조사받은 환아에서 치아형성장애의 위험이 더 증가된다고 하였고, 화학요법과 방사선요법은 독립 위험 요소로 평가되었다. 이 연구에서 화학요법만을 경험한 환아보다 화학요법과 방사선요법을 모두 경험한 환아에서 왜소치, 결손치, 치근이상이 더 빈번하게 발견된 점으로 보아 화학요법과 함께 방사선 요법의 적용도 치아의 형성장애에 영향을 미치는 것으로 평가된다. 기존의 연구에서 동물실험을 통해 알킬화제인 cyclophosphamide가 유사분열 S-phase동안 DNA에 결합하여 치수 내 간엽세포와 전구조상아세포의 조기 세포사를 유발하는 것으로 나타났으며[17], Minicucci 등[3]은 10 Gy의 방사선 조사 시 성숙한 법랑모세포에 영구적 손상이 발생한다고 하였다. 또한, 경조직개시시기의 강하고 반복적인 화학요법이 치아 무형성을 초래할 수 있으며, 항암요법에 따른 조상아세포의 활성 변화가 치근의 형태 변화를 가져온다고 보고하였다.
항암 치료를 받은 후 나타나는 치아의 장애는 항암 치료 시기의 해당 치아의 발달 단계에 따라 달라지는데, 동물실험에서는 더 어린 동물일 수록 치열에 더 많은 영향을 받았다[3]. 또한, 치아 발달이 완성된 이후에도 치근이 영향을 받아 단근화 되거나 부분석회화 치수강이나 법랑질 결함이 발생할 수 있다고 보고된 바 있다[7]. 두경부 방사선 치료와 함께, busulfan, actinomycin D, vincristine, cyclophosphamide, 및 daunorubicin 등의 약물이 치아 형성장애에 영향을 미치는 것으로 알려졌다[16].
이 연구와 같이, 현재까지 보고된 다양한 구강 내 합병증에도 불구하고 방사선 요법과 화학요법은 수술을 동반하거나 그렇지 않은 경우를 막론하고 가장 효과적인 항암치료 방법이며[18], 환자의 생존을 위해 필수적이다. Tomizawa 등[19]은 항암 치료 방법의 발전으로 인해 지난 30여년간 백혈병 환자의 생존율은 명백히 증가하였다고 보고하였다.
항암 치료를 18개월 보다 더 오랜 기간에 걸쳐 받은 경우에 치아에 더 많은 이상을 나타냈다. 이는 항암 치료의 개시 시기, 치료 방법, 치료 기간이 치아 형성이상에 영향을 미치는 요소에 포함된다고 할 수 있다.
항암 치료 경험이 있는 환자를 치료하기 앞서, 임상가는 환자의 기왕력에 대해 더욱 정확하고 자세히 알아야 할 의무가 있으며, 특히 치료 기간, 치료 과정, 그리고 치료 시기 등을 면밀히 살피고, 환자에서 나타날 수 있는 여러 구강이상에 대해 정확하게 파악하여 필요한 처치를 시행하여야 한다. 형태 이상 치아가 발생한 경우, 이에 대한 유지관리 및 적절한 보철치료가 고려될 수 있으며, 아직 환자의 나이가 유치열기에 머물러 있다면 유치의 보존적 관리나 공간 관리 등을 포함한 향후 결손치아에 대한 준비과정이 필수적일 것이다.
이 연구에서, 항암치료를 경험한 환아들의 61.3%에서 치아 발육의 이상이 관찰되었다. 항암 치료 개시 시기가 6세 이전인 경우, 그 이후에 치료를 시작한 경우보다 왜소치 및 결손치의 수가 더 많이 관찰되었다. 항암 치료 방법에 있어 화학 및 방사선 요법을 병행한 경우에는 화학 요법만을 사용한 경우보다 왜소치, 결손치, 그리고 치근형태이상 치아가 더 많이 관찰되었다. 또한, 치료 기간이 18개월 이상인 경우에는 이보다 더 짧은 치료기간을 갖는 경우보다 왜소치, 결손치, 치근형태이상 치아가 더 많이 관찰되었다. 더 이른 항암치료 개시시기, 두 치료 요법의 병행, 그리고 더 긴 항암치료 시기가 치아 발달 장애에 영향을 미치는 요소에 포함된다고 할 수 있다.
Fig 1.
Microdontia of the maxillary right premolars (A), left second premolar (B), and the mandibular right second premolar (C), and second molar (D).
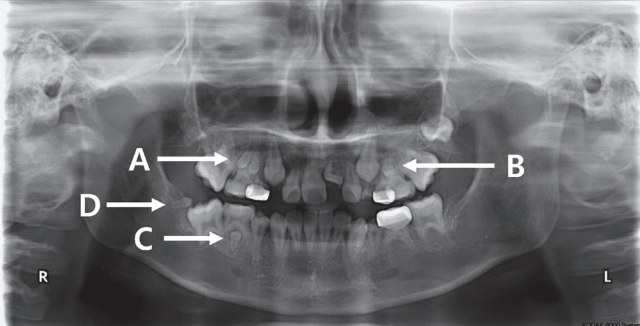
Fig 2.
The patient is 7 years old. Note, delayed formation of the maxillary first premolars (A), taurodontism on the mandibular primary molars (B), and missing teeth on the mandibular premolars (C).

Table 1.
Distribution of the patients according to the diagnosis
| Diagnosis | Number |
|---|---|
| Acute lymphoid leukemia | 46 |
| Acute myeloid leukemia | 10 |
| Sarcoma | 9 |
| Neuroblastoma | 9 |
| Lymphoma | 6 |
| Medulloblastoma | 4 |
| Wilm’s tumor | 3 |
| Chronic myeloid leukemia | 2 |
| Others | 4 |
| Total | 93 |
Table 2.
Distribution of the patients according to the age of treatment onset
| Age | Number |
|---|---|
| 1 | 1 |
| 2 | 6 |
| 3 | 8 |
| 4 | 10 |
| 5 | 8 |
| 6 | 14 |
| 7 | 21 |
| (8 | 11 |
| 9 | 4 |
| 10 | 4 |
| 11 | 6 |
| Total | 93 |
Table 3.
Distribution of the patients according to the treatment modality
| Treatment modality | Number |
|---|---|
| Chemotherapy | 74 |
| Radiation and chemotherapy | 19 |
| Total | 93 |
Table 4.
Distribution of the patients according to the treatment duration
| Treatment duration | Number |
|---|---|
| < 1.5 years | 47 |
| ≥ 1.5 years | 46 |
| Total | 93 |
Table 5.
Distribution of the patients and dental abnormalities according to the diagnosis
Table 6.
Distribution of dental abnormalities according to the age of treatment onset
Table 7.
Distribution of dental abnormalities according to the treatment modality
Table 8.
Distribution of dental abnormalities according to the treatment duration
References
1. Pappo AS, Furman WL, Krailo MD, et al. : Rare tumors in children: progress through collaboration. J Clin Oncol, 33:3047-3054, 2015.



2. Cancer resgistration statistics by Korean Statistical Information Service in 2015. Available from URL: http://kosis.kr/statHtml/statHtml.do?orgId=117&tblId=DT_117N_A11107&conn_path=I2 (Accessed on June 1, 2018)
3. Minicucci EM, Lopes LF, Crocci AJ : Dental abnormalities in children after chemotherapy treatment for acute lymphoid leukemia. Leuk Res, 27:45-50, 2003.


4. Casamassimo PS, Fields HW, McTigue DJ, Nowak AJ : Pediatric Dentistry. 5th. Louis, 2013.
5. Kumar V, Abbas AK, Fausto N, Mitchell RN : Robbins Basic Pathology. 8th. Louis, 2007.
6. Hong CH, Napeñas JJ, Brennan MT, et al. : A systemic review of dental disease in patients undergoing cancer therapy. Support Care Cancer, 18:1007-1021, 2010.



7. Lopez NN, Petrilli AS, Lederman H, et al. : Dental abnormalities in children submitted to antineoplastic therapy. 73:140-145, 2006.

8. Baik BJ, Park JR, Kim JG, Lee DC : A study of the size of permanent teeth. J Korean Acad Pediatr Dent, 30:502-509, 2003.
9. Kim DS, Kim YJ, Choi JH, Han JH : A study of Korean norm about tooth size and ratio in Korean adults with normal occlusion. Korean J Orthod, 31:505-515, 2001.
10. Lee NY, Hong SS, Lee SH : Dental crowding and its relationship to tooth size and arch dimension in Korean. J Korean Acad Pediatr Dent, 33:510-521, 2006.
11. Kwon JH, Choi BJ, Choi HJ, et al. : Eruption time and sequence of permanent teeth in students from E-elementary school. J Korean Acad Pediatr Dent, 36:253-261, 2009.
12. Korean Academy of Pediatric Dentistry : Textbook of Pediatric Dentistry. 5th. Dental Wisdom Yenang INC. Seoul, 93-142, 2014.
13. Proc P, Szczepańska J, Młynarski W, et al. : Dental anomalies as late adverse effect among young children treated for cancer. Cancer Res Treat, 48:658-667, 2016.


14. Sonis AL, Tarbell N, Sallan S, et al. : Dentofacial development in long-term survivors of acute lymphoblastic leukemia. Cancer, 66:2645-2652, 1990.


15. Jeong KH, Kim D, Kim YH, et al. : Epidemiology and genetics of hypodontia and microdontia: a study of twin families. Angle Orthod, 85:980-985, 2015.


16. Nunn JH, Welbury RR, Craft AW, et al. : Dental caries and dental anomalies in children treated by chemotherapy for malignant disease: a study in the north of England. Int J Paediatr Dent, 1:131-135, 1991.


17. Kaste SC, Goodman P, Baker KS, et al. : Impact of radiation and chemotherapy on risk of dental abnormalities: a report from the childhood cancer survivor study. Cancer, 115:5817-5827, 2009.



- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 1,900 View
- 135 Download
- Related articles
-
Status and Survey of Pulp Treatment by Korean Pediatric Dentists2020 August;47(3)
Sevoflurane Sedation Using a Nasal Cannula in Pediatric Patients2013 August;40(3)




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print