|
 |
| J Korean Acad Pediatr Dent > Volume 42(1); 2015 > Article |
|
мҙҲлЎқ
ліё м—°кө¬мқҳ лӘ©м ҒмқҖ Streptococcus mutansмқҳ Ag I/IIмҷҖ glucosyltransferaseм—җ лҢҖн•ҙ к°ңл°ңлҗң лӢЁмқјнҒҙлЎ н•ӯмІҙлҘј мӮ¬мҡ©н•ң нғҖм•Ў лӮҙ Streptococcus mutans кІҖм¶ңмқҳ нҡЁмҡ©м„ұмқ„ нҸүк°Җн•ҳкё° мң„н•ЁмқҙлӢӨ. м„ё кө°(м„ұмқё, лҜём„ұл…„мһҗ, к·ёлҰ¬кі көҗм •м№ҳлЈҢмӨ‘мқё лҜём„ұл…„мһҗ)мқ„ лҢҖмғҒмңјлЎң DMFT, DentocultВ®-SM strip mutansлҘј мқҙмҡ©н•ң нғҖм•ЎлӮҙмқҳ colony density (CFU/mL), polymerase chain reactionмқ„ мқҙмҡ©н•ң Sreptococcus mutansмҷҖ Sreptococcus sobrinusмқҳ мЎҙмһ¬м—¬л¶Җ, к·ёлҰ¬кі 4к°Җм§Җ лӢЁмқјнҒҙлЎ н•ӯмІҙлҘј мӮ¬мҡ©н•ң нғҖм•Ў лӮҙ Streptococcus mutans кІҖм¶ң мӢӨн—ҳмқ„ мӢңн–үн•ҳмҳҖлӢӨ. к·ё кІ°кіј Streptococcus mutansк°Җ Streptococcus sobrinusліҙлӢӨ м№ҳм•„ мҡ°мӢқ нҳ•м„ұм—җ лҚ” мЈјмҡ”н•ҳкІҢ мһ‘мҡ©н•ңлӢӨлҠ” кІғмқ„ мһ…мҰқн•ҳмҳҖмңјл©°, glucosyltransferases (gtf B, gtf C, gtf D)мҷҖ Ag I/IIм—җ лҢҖн•ң лӢЁмқјнҒҙлЎ н•ӯмІҙл“Өмқҳ Streptococcus mutansлҘј кІҖм¶ңн•ҙ лӮҙлҠ” лҠҘл Ҙмқҙ DentocultВ®-SM strip mutansлӮҳ polymerase chain reactionмқ„ мӮ¬мҡ©н•ң кІҖм¶ңлІ•ліҙлӢӨ лӣ°м–ҙлӮЁмқ„ ліҙмҳҖлӢӨ.
Abstract
The purpose of this study was to determine the usefulness of a detection method for Streptococcus mutans in saliva with monoclonal antibodies developed targeting Ag I/II and glucosyltransferases (gtf B, gtf C and gtf D) in Streptococcus mutans. In the three groups tested (adults, minors, and minors under orthodontic treatment), the results of the DMFT scores, the colony density (CFU/mL) in their saliva was measured using DentocultВ®-SM strip mutans, polymerase chain reaction was performed to test whether Streptococcus mutans and Streptococcus mutans were present, and Streptococcus mutans detecting tests performed in their saliva using four types of monoclonal antibody were collected.
In conclusion, it was demonstrated that the Streptococcus mutans plays more important role in forming dental caries compared to Streptococcus sobrinus, and that the monoclonal antibodies against glucosyltransferases (gtf B, gtf C, gtf D) and Ag I/II of Streptococcus mutans are superior in detecting Streptococcus mutans to DentocultВ®-SM strip mutans or polymerase chain reaction.
м№ҳм•„мҡ°мӢқмҰқмқҖ кө¬к°• кұҙк°•кіј кҙҖл Ён•ҳм—¬ м „ м„ёкі„м ҒмңјлЎң л¬ём ңк°Җ лҗҳкі мһҲлҠ” кө¬к°•м§ҲнҷҳмңјлЎңм„ң м„ёкі„ліҙкұҙкё°кө¬(WHO)мқҳ ліҙкі м—җ л”°лҘҙл©ҙ м№ҳм•„мҡ°мӢқмҰқмқҖ м„ёкі„ мқёкө¬мқҳ м•Ҫ 60%м—җм„ң л°ңлі‘н•ҳлҠ” кІғмңјлЎң ліҙкі лҗҳм—ҲлӢӨ[1]. мҡ°лҰ¬лӮҳлқјмқҳ кІҪмҡ° 2012л…„ көӯлҜјкө¬к°•кұҙк°•мӢӨнғңмЎ°мӮ¬ мһҗлЈҢлҘј 분м„қн•ң кІ°кіј, м№ҳм•„мҡ°мӢқкІҪн—ҳм§ҖмҲҳ(DMFT ; Decayed, Missing, and Filled teeth)к°Җ м җм°Ё к°җмҶҢлҗҳм–ҙк°ҖлҠ” 추세мқҙлӮҳ м—¬м „нһҲ м№ҳм•„мҡ°мӢқмҰқмқҖ кө¬к°•кұҙк°•мқ„ мң„нҳ‘н•ҳлҠ” лҢҖн‘ңм Ғмқё м§ҲнҷҳмқҙлӢӨ[2].
KeyesмҷҖ Jordan[3]мқҖ м№ҳм•„мҡ°мӢқмҰқмқҳ л°ңмғқмҡ”мқёмқ„ м„ёк· , лӢ№л¶„, мҲҷмЈј мқёмһҗлЎң кө¬л¶„н•ҳм—¬ мқҙл“Өмқҙ лӘЁл‘җ кҙҖм—¬н•ҳм—¬ мӨ‘ліөлҗ л•Ң мҡ°мӢқмқҙ л°ңмғқн•ңлӢӨкі м„ӨлӘ…н•ҳмҳҖлӢӨ. к·ё нӣ„ мҡ°мӢқмқҙ л§Ңм„ұм§Ҳнҷҳмқё м җмқ„ к°җм•Ҳн•ҳм—¬ мқҙл“Өм—җ м ң4мқҳ мқёмһҗмқё мӢңк°„мқ„ нҸ¬н•ЁмӢңмј°кі , м§ҖмҶҚм Ғмқё м—°кө¬лҘј нҶөн•ҙ м№ҳм•„мҡ°мӢқмҰқмқҳ лі‘мқёмңјлЎң нҷҳкІҪм Ғ м—¬лҹ¬ мҡ”мқёл“Өмқҙ кі л Өлҗҳл©ҙм„ң мҡ°мӢқлі‘мқёлЎ мқҳ лҳҗ лӢӨлҘё лӘЁлҚёмқҙ м ңмӢңлҗҳкі мһҲлӢӨ[4].
мқҙмҷҖ к°ҷмқҙ лӢӨм–‘н•ң мқёмһҗл“Өмқҙ кҙҖм—¬н•ҳлҠ” м№ҳм•„мҡ°мӢқмҰқмқҳ мқјм°Ём Ғ мӣҗмқёмқҖ м№ҳл©ҙм„ёк· л§ү лӮҙм—җ мЎҙмһ¬н•ҳлҠ” м„ёк· мңјлЎң м•Ңл Өм ё мһҲмңјл©°, мӢӨм ң кө¬к°•м—җм„ң м№ҳнғңлҘј мқҙлЈЁлҠ” м„ёк· л“Өмқҙ мЎҙмһ¬н•ҳм§Җ м•ҠлҠ”лӢӨл©ҙ мҡ°мӢқмқҖ л°ңмғқн•ҳм§Җ м•ҠлҠ”лӢӨ[5]. м№ҳм•„мҡ°мӢқмҰқмқҖ м№ҳл©ҙм„ёк· л§ү лӮҙм—җ мЎҙмһ¬н•ҳлҠ” м„ёк· л“Өмқҳ лӢ№м§Ҳ лҢҖмӮ¬мӮ°л¬јмқё м –мӮ° л“ұмқҳ мң кё°мӮ°м—җ мқҳн•ҙ м№ҳм•„мқҳ лІ•лһ‘м§Ҳмқҙ нғҲнҡҢлҗҳл©ҙм„ң л°ңмғқн•ҳлҠ”лҚ°, мқҙлҹ¬н•ң м„ёк· л“ӨлЎңлҠ” Streptococcus mutans (S. mutans)мҷҖ Streptococcus sobrinus (S. sobrinus)лҘј нҸ¬н•Ён•ҳлҠ” mutans streptococciк°Җ мһҲмңјл©°, к·ё мӨ‘ S. mutansк°Җ мҡ°мӢқлі‘мҶҢлҘј мң л°ңн•ҳлҠ” к°ҖмһҘ мЈјмҡ”н•ң м„ёк· мқҙлқјлҠ” кІғмқҙ л°қнҳҖмЎҢлӢӨ[6].
м№ҳм•„мҡ°мӢқмҰқмқҳ л°ңлі‘лЎ мқҖ 3к°Җм§Җ лӢЁкі„к°Җ м ңмӢңлҗҳкі мһҲлҠ”лҚ°, к·ё мІ« лӢЁкі„лҠ” sucrose-лҸ…лҰҪ лӢЁкі„лЎң S. mutansлҠ” S. mutansмқҳ н‘ңл©ҙ н•ӯмӣҗ лӢЁл°ұм§Ҳмқё Ag I/IIм—җ мқҳн•ҙ м№ҳл©ҙ м„ёк· л§үм—җ л¶Җм°©н•ңлӢӨ. л‘җ лІҲм§ё лӢЁкі„лҠ” sucrose-мў…мҶҚ лӢЁкі„лЎң м„ӯм·Ёлҗң sucroseлҘј мқҙмҡ©н•ҳм—¬ S. mutansк°Җ мғқм„ұн•ҳлҠ” glucosyltransferase (gtfs)м—җ мқҳн•ҙ м ‘м°©м„ұмқҙ к°•н•ң glucanмқҙ нҳ•м„ұлҗҳм–ҙ glycocalyxк°Җ л§Ңл“Өм–ҙм§Җкі , м„ёк· мқҳ glucan binding proteins (GBP)м—җ мқҳн•ҙ лӢӨлҘё м„ёк· л“Өкіј 집лқҪмқ„ мқҙлЈЁм–ҙ, м№ҳм•„ н‘ңл©ҙм—җ л¶ҷлҠ” S. mutansмқҳ мҲҳк°Җ м җм җ мҰқк°Җн•ңлӢӨ. м„ё лІҲм§ё лӢЁкі„лЎң 축м Ғлҗң м№ҳнғң лӮҙ м„ёк· мқҙ мӮ°мқ„ мғқм„ұн•ҳкі , мң лҰ¬лҗң мӮ°мқҙ м№ҳм•„лҘј нғҲнҡҢмӢңмјң м№ҳм•„мҡ°мӢқмҰқмқ„ м•јкё°н•ҳкІҢ лҗңлӢӨ[7].
мқҙ мӨ‘ м„ёк· мқҙ м№ҳл©ҙм—җ л¶Җм°©н•ҳлҠ” кІғмқҖ м№ҳм•„ мҡ°мӢқмҰқмқҙ л°ңмғқн•ҳлҠ” мІ« лІҲм§ё лӢЁкі„лЎң мқҙ лӘЁл“ мқјл Ёмқҳ кіјм •мқҙ мӢңмһ‘лҗҳлҠ” к°ҖмһҘ мӨ‘мҡ”н•ң лӢЁкі„лқј н• мҲҳ мһҲлӢӨ. л”°лқјм„ң S. mutansмқҳ лҸ…м„ұмқёмһҗлҘј лҢҖмғҒ н•ӯмӣҗмңјлЎң н•ң м—°кө¬к°Җ л§Һмқҙ 진н–ү мӨ‘мқҙл©°, нҠ№нһҲ м„ёк· мқҳ л¶Җм°©м—җ кҙҖм—¬н•ҳлҠ” лӢЁл°ұм§Ҳмқё Ag I/в…Ў, gtfs, GBPм—җ 집мӨ‘н•ҳм—¬, мөңк·ј мӢӨм ңлЎң мқҙкІғмқ„ мқҙмҡ©н•ҙ мҡ°мӢқ мҳҲл°©м—җ нҡЁкіјлҘј кұ°л‘” м—°кө¬л“Өмқҙ л°ңн‘ңлҗҳкі мһҲлӢӨ[8].
мқҙ м—°кө¬м—җм„ңлҠ” S. mutansмқҳ н‘ңл©ҙм—җ л°ңнҳ„лҗҳм–ҙ лҸ…м„ұмқ„ лӮҳнғҖлӮҙлҠ” Ag I/II лӢЁл°ұм§Ҳкіј S. mutansк°Җ мғқм„ұн•ҳм—¬ м№ҳнғңлҘј л§Ңл“ңлҠ” gtfsм—җ лҢҖн•ҳм—¬ к°ңл°ңлҗң лӢЁмқјнҒҙлЎ н•ӯмІҙл“Өмқ„ к°Җм§Җкі , мқҙл“Өмқ„ нғҖм•Ўм—җ м Ғмҡ©н–Ҳмқ„ л•Ң лӢЁмқјнҒҙлЎ н•ӯмІҙл“Өмқҙ S. mutansлҘј кІҖм¶ңн•ҙ лӮҙлҠ” лҠҘл Ҙмқ„ нҷ•мқён•ҳкі мһҗ, DMFTмҷҖ DentocultВ®-SM strip mutansлҘј мқҙмҡ©н•ң colony density, к·ёлҰ¬кі polymerase chain reaction(PCR) л“ұмқ„ мЎ°мӮ¬н•ҳм—¬ 비көҗн•ҳмҳҖлӢӨ.
ліё м—°кө¬лҠ” м „л¶ҒлҢҖн•ҷкөҗлі‘мӣҗмқҳ мһ„мғҒ м—°кө¬ мңӨлҰ¬ мң„мӣҗнҡҢ(Institutional Review Board, IRB)мқҳ м§Җм№Ём—җ л”°лқј мҲҳлҰҪн•ҳмҳҖмңјл©°, мӢ¬мқҳ м Ҳм°Ё кіјм •мқ„ нҶөкіјн•ҳмҳҖлӢӨ(IRBлІҲнҳё : 2011-07-025-001).
мқҙ м—°кө¬лҠ” S. mutansмҷҖ м№ҳм•„мҡ°мӢқ к°„мқҳ мң мқҳм Ғ м—°кҙҖм„ұм—җ лҢҖн•ҙ м•Ңм•„ліҙкі мһҗ м„ё кө°мқ„ лҢҖмғҒмңјлЎң мӢңн–үлҗҳм—ҲлӢӨ. м„ұмқёкіј лҜём„ұл…„мһҗмқҳ м°ЁмқҙлҘј нҸүк°Җн•ҳкё° мң„н•ҙ к°Ғк°Ғмқ„ лӢӨлҘё кө°мңјлЎң лӮҳлҲ„м–ҙ мӢӨн—ҳ лҢҖмғҒмһҗлЎң м„Өм •н•ҳмҳҖмңјл©°, көҗм • м№ҳлЈҢ мң л¬ҙм—җ л”°лҘё м°ЁмқҙлҘј м•Ңм•„ліҙкё° мң„н•ҙ көҗм • м№ҳлЈҢ мӨ‘мқё лҜём„ұл…„мһҗ н•ң кө°мқ„ лҚ”н•ҳм—¬ мөңмў… мӢӨн—ҳ лҢҖмғҒмһҗлҘј м„ё кө°мңјлЎң м„Өм •н•ҳмҳҖлӢӨ. лҜём„ұл…„мһҗмқё мӢӨн—ҳ лҢҖмғҒмһҗл“ӨмқҖ мӢӨн—ҳ кІ°кіјмқҳ м•Ҳм •м„ұкіј DMFTлҘј м–»кё° мң„н•ҙ л§Ң 10м„ё мқҙмғҒл§Ң мӢӨн—ҳм—җ м°ём—¬н•ҳмҳҖлӢӨ. 1кө°мқҖ м „л¶ҒлҢҖн•ҷкөҗ м№ҳкіјлі‘мӣҗ мҶҢм•„м№ҳкіјм—җм„ң көҗм • м№ҳлЈҢ мӨ‘мқё нҷҳмһҗл“Ө мӨ‘, нҠ№лі„н•ң мқҳкіјм Ғ лі‘л Ҙмқҙ м—ҶлҠ” л§Ң 10м„ё мқҙмғҒмқҳ көҗм • нҷҳмһҗ 31лӘ…(л§Ң 13.5м„ё, лӮЁл…Җ 16 : 15), 2кө°лҠ” нҠ№лі„н•ң мқҳкіјм Ғ л°Ҹ м№ҳкіјм Ғ лі‘л Ҙмқҙ м—ҶлҠ” л§Ң 10м„ё мқҙмғҒмқҳ м „мЈјмӢң мҙҲл“ұн•ҷкөҗ 5н•ҷл…„ н•ҷмғқ 25лӘ…(л§Ң 10.2м„ё, лӮЁл…Җ 11 : 14), к·ёлҰ¬кі 3кө°мқҖ нҠ№лі„н•ң мқҳкіјм Ғ лі‘л Ҙмқҙ м—ҶлҠ” 20~30лҢҖ м„ұмқё 41лӘ…(л§Ң 28.4м„ё, лӮЁл…Җ 25 : 16)мқ„ лҢҖмғҒмңјлЎң н•ҳмҳҖлӢӨ. мқҙ м—°кө¬лҘј мң„н•ҙ мҙқ 97лӘ…мқҳ н”јмӢӨн—ҳмһҗк°Җ м°ём—¬н•ҳмҳҖлӢӨ.
м—°кө¬ лҢҖмғҒмһҗл“ӨмқҖ кө¬к°• кІҖмӮ¬ м „м—җ мӢқмӮ¬лҘј н•ң нӣ„ 칫мҶ”м§Ҳмқ„ н•ҳм§Җ м•Ҡкі мӢӨн—ҳм—җ м°ём—¬н•ҳмҳҖлӢӨ. лҸҷмқјн•ң кІҖмӮ¬мһҗм—җ мқҳн•ң кө¬к°• кІҖмӮ¬ нӣ„, мҡ°мӢқкІҪн—ҳм№ҳм•„мҲҳк°Җ кё°лЎқлҗҳм—Ҳкі , нҢҢлқјн•Җ мҷҒмҠӨлҘј мӮ¬мҡ©н•ҳм—¬ мһҗк·№м„ұ нғҖм•Ўмқ„ 10~15 mLм”© мұ„м·Ён•ҳмҳҖмңјл©°, мұ„м·Ёлҗң нғҖм•ЎмқҖ кІҖмӮ¬ мӢңмһ‘ м „к№Ңм§Җ -20в„ғм—җ ліҙкҙҖн•ҳмҳҖлӢӨ. мӢӨн—ҳ лҢҖмғҒмһҗм—җкІҢ мӢӨн—ҳмқҳ лӘ©м Ғкіј л°©лІ•мқ„ мғҒм„ён•ҳкІҢ м„ӨлӘ…н•ҳкі лҸҷмқҳлҘј м–»м—Ҳмңјл©°, лҢҖмғҒмһҗк°Җ лҜём„ұл…„мһҗмқё кІҪмҡ°м—җлҠ” ліҙнҳёмһҗм—җкІҢлҸ„ лҸҷмқҳлҘј м–»мқҖ нӣ„ м—°кө¬лҘј 진н–үн•ҳмҳҖлӢӨ.
м—°кө¬ лҢҖмғҒмһҗмқҳ кө¬к°•мғҒнғңлҘј мЎ°мӮ¬н•ҳкё° мң„н•ҳм—¬ лҸҷмқјн•ң кІҖмӮ¬мһҗ(м№ҳкіјмқҳмӮ¬)к°Җ м№ҳкІҪкіј нғҗм№Ёмқ„ мқҙмҡ©н•ҳм—¬ мЎ°мӮ¬н•ҳмҳҖлӢӨ. м„ёкі„ліҙкұҙкё°кө¬м—җм„ң м ңмӢңн•ң м§Җн‘ңлҘј кё°мӨҖмңјлЎң мғҒн•ҳмўҢмҡ° м ң3лҢҖкө¬м№ҳлҘј м ңмҷён•ң 28к°ңмқҳ м№ҳм•„лҘј лҢҖмғҒмңјлЎң мҡ°мӢқм№ҳм•„, мғҒмӢӨм№ҳм•„, м¶©м „м№ҳм•„лҘј мЎ°мӮ¬н•ҳм—¬ DMFTлҘј мӮ°м •н•ҳмҳҖлӢӨ. мҡ°мӢқм№ҳм•„лҠ” international caries detection and assessment system (ICDAS)лҘј кё°мӨҖмңјлЎң grade 0м—җ н•ҙлӢ№н•ҳлҠ” л°ұмғүл°ҳм җ лҳҗлҠ” л°ұл¬өм–‘л°ҳм җ л“ұмқҳ мҙҲкё° м№ҳм•„ мҡ°мӢқмҰқмқҳ м№ҳм•„лҠ” кұҙм „м№ҳм•„лЎң нҢҗм •н•ҳмҳҖлӢӨ[9].
DentocultВ®-SM strip mutans (Orion Diagnostica, Espoo, Finland)лӮҙмқҳ нҢҢлқјн•Җмқ„ мҲҳ 분간 м”№кІҢ н•ҳм—¬ нғҖм•Ўмқ„ мҲҳ집 нӣ„ л°°м§ҖнҢҗмқ„ нҳҖм—җ лҢҖкі screening strip м „мІҙл©ҙм—җ нғҖм•Ўмқҙ 충분нһҲ 묻лҸ„лЎқ н•ңлӢӨ. лҜёлҰ¬ bacitracin discлҘј л…№мқё л°°м–‘м•Ўм—җ л„Јм–ҙ л§Ҳк°ңлҘј мЎ°кёҲ лҠҗмҠЁн•ҳкІҢ мһ к·ј нӣ„, 37в„ғ н•ӯмҳЁ л°°м–‘кё°м—җм„ң 48мӢңк°„ л°°м–‘н•ҳм—¬ м ңмһ‘нҡҢмӮ¬мқҳ нҢҗм •н‘ңмқҳ кё°мӨҖм—җ мқҳн•ң S. mutansмқҳ 집лқҪ мҲҳм—җ л”°лқј, мҡ°мӢқнҷңм„ұлҸ„лҘј grade 0~3мңјлЎң нҢҗм •н•ҳмҳҖлӢӨ(Table 1).
нғҖм•Ў лӮҙ S. mutansмҷҖ S. sobrinusмқҳ мЎҙмһ¬м—¬л¶ҖлҠ” PCR мӢӨн—ҳмқ„ нҶөн•ҙ нҷ•мқён•ҳмҳҖлӢӨ. мӢӨн—ҳм—җ мӮ¬мҡ©лҗң primerлҠ” 5-GATAACTACCTGACAGCTGACT-3'кіј 5'-AAGCTGCCTTAAGGTAATCACT-3'мқҙ S. sobrinusм—җ лҢҖн•ҙ мӮ¬мҡ©лҗҳм—Ҳмңјл©°, 5'-ATGCGCAATCAACAGGTT-3'кіј 5-CGCAACGCGAACATCTTGATCAG-3'мқҙ S. mutansлҘј мң„н•ҙ мӮ¬мҡ©лҗҳм—ҲлӢӨ. PCRмӢӨн—ҳмқ„ мң„н•ң мҙқ м–‘мқҖ 20 ОјLлЎң DNA 1 ОјLмҷҖ 5 Г— PCR mixture (ELPIS, Taejeon, Korea) 4 ОјL, 5 pM primer 1 ОјL, мҰқлҘҳмҲҳ 14 ОјLлЎң мқҙлЈЁм–ҙмЎҢлӢӨ. PCR л°ҳмқ‘мқҖ 95в„ғм—җм„ң 1분간 denaturation нӣ„, 95в„ғм—җм„ң 10мҙҲк°„ denaturation, 58в„ғм—җм„ң 10мҙҲк°„ annealing, 72в„ғм—җм„ң 10мҙҲк°„ extension кіјм •мқ„ 30cycle мҲҳн–үн•ҳмҳҖмңјл©°, к·ё нӣ„ 72в„ғм—җм„ң 5분간 extension н•ҳмҳҖлӢӨ. PCR мӢӨн—ҳмқ„ нҶөн•ҙ лӮҳмҳЁ мӮ°л¬јмқҖ 1% м•„к°ҖлЎңмҰҲ м Өм—җм„ң 분м„қлҗҳм—ҲлӢӨ.
мқҙ мӢӨн—ҳм—җ мӮ¬мҡ©лҗң S. mutansмқҳ Ag I/II лӢЁл°ұм§Ҳкіј gtfs (gtf B, gtf C, gtf D)м—җ лҢҖн•ң лӢЁмқјнҒҙлЎ н•ӯмІҙлҠ” кё°мЎҙм—җ м ңмһ‘лҗң н•ӯмІҙл“Өмқ„ мӮ¬мҡ©н•ҳмҳҖлӢӨ. мқҙ н•ӯмІҙл“Өмқ„ м–»кё° мң„н•ҙм„ң Ag I/II лӢЁл°ұм§Ҳкіј gtfs(gtf B, gtf C, gtf D)мқҳ N-terminus мң м „мһҗлҘј PCRмқ„ нҶөн•ҙ мҰқнҸӯн•ҳмҳҖлӢӨ. мқҙлҘј T лІЎн„°м—җ ligationн•ҳм—¬ sequencingмқ„ нҶөн•ҙ м •нҷ•н•ң sequenceлҘј к°Җ진 лІЎн„°лҘј м„ нғқн•ҳм—¬ м ңн•ңнҡЁмҶҢлЎң мһҳлқј plasmidм—җ integrationн•ҳм—¬ м–»м–ҙ진 лІЎн„°лҘј мқҙмҡ©н•ҙ мһ¬мЎ°н•© лӢЁл°ұм§Ҳл“Ө(Ag I/II-N, gtfBN, gtfCN, gtfDN)мқ„ л°ңнҳ„мӢңмј°кі , мқҙлҘј нҷ•мқён•ҳмҳҖлӢӨ. мқҙ лӢЁл°ұм§Ҳл“Өмқ„ м •м ңн•ҳм—¬ miceм—җ мЈјмһ…н•ҳмҳҖмңјл©°, м–»м–ҙ진 spleen cellмқ„ SP2/0 cellкіј fusionн•ҳм—¬ hybridomaлҘј мғқм„ұн•ҳмҳҖлӢӨ. Western blotкіј Dot blot, к·ёлҰ¬кі ELISAлҘј нҶөн•ҙ мқҙ hybridomaк°Җ Ag I/II-N, gtfBN, gtfCN, gtfDNм—җ лҢҖн•ң лӢЁмқјнҒҙлЎ н•ӯмІҙ anti-Ag I/II antibody, anti-gtfBN antibody, anti-gtfCN antibody, anti-gtfDN antibody (ckAg I/II, ckBN, ckCN, ckDN)лҘј мғқм„ұн•Ёмқ„ нҷ•мқён•ҳмҳҖлӢӨ.
нғҖм•Ў лӮҙ S. mutansлҘј кІҖм¶ңн•ҳкё° мң„н•ҙ enzyme-linked immunosorbent assay (ELISA) мӢӨн—ҳл°©лІ•мқ„ мӮ¬мҡ©н•ҳмҳҖлӢӨ. ELISA мӢӨн—ҳмқ„ мң„н•ҙ 20 ОјLмқҳ мһ¬мЎ°н•© Ag I/II лӢЁл°ұм§Ҳкіј gtfs(gtf B, gtf C, gtf D)лЎң мҪ”нҢ…н•ң 96-well н”Ңл ҲмқҙнҠё(Nunc, Roskilde, Denmark)м—җ 100 ОјLмқҳ нғҖм•Ўмқ„ л„ЈмқҖ нӣ„ 4в„ғм—җм„ң н•ҳлЈЁ м Җл…Ғ лҶ“м•„л‘җм—ҲлӢӨ. мқҙкІғмқ„ 3% skim milkлЎң мғҒмҳЁм—җм„ң 30분 м°ЁлӢЁмӢңнӮЁ лӢӨмқҢ phosphate buffered saline (PBS)лЎң 3лІҲ м”»мқҖ нӣ„ к°Ғ лӢЁмқјн•ӯмІҙлҘј л„Јм–ҙ 37в„ғм—җм„ң 1мӢңк°„ incubationн•ҳмҳҖлӢӨ. PBSлЎң м”»м–ҙ н•ӯмІҙ м ңкұ° нӣ„ alkaline phosphateк°Җ л¶ҷмқҖ goat anti-mouse immunoglobulin G (Sigma Chemical Co., St. Louis, MO, USA)лҘј 37в„ғм—җм„ң 1мӢңк°„ incubationн•ҳмҳҖлӢӨ. мқҙкІғмқ„ PBSлЎң 4лІҲ м”»мқҖ нӣ„ alkaline phosphatase substrateлҘј л„Јм–ҙ, ELISA reader (Packard Instrument Co., Downers Grove, IL, USA)кё°м—җм„ң 405 nmлЎң мёЎм •н•ҳмҳҖлӢӨ.
к°Ғ м—°кө¬ лҢҖмғҒмһҗл“Өмқҳ DMFTмҷҖ DentocultВ®-SM strip mutans, PCRмқ„ мқҙмҡ©н•ң S. mutansмҷҖ S. sobrinusмқҳ мЎҙмһ¬мң л¬ҙ, к·ёлҰ¬кі 4к°Җм§Җмқҳ лӢЁмқјнҒҙлЎ н•ӯмІҙлҘј мӮ¬мҡ©н•ң нғҖм•Ў лӮҙмқҳ S. mutans кІҖм¶ңмӢӨн—ҳмқҳ мһҗлЈҢлҘј SPSS (Statistical Package for Social Science) Ver 19.0 нҶөкі„ н”„лЎңк·ёлһЁмқ„ мӮ¬мҡ©н•ҳм—¬ 분м„қн•ҳмҳҖлӢӨ. к°Ғ кө°л“Өмқҳ DMFT, DentocultВ®-SM strip mutans, S. mutansмҷҖ S. sobrinusмқҳ PCR кІ°кіј, к·ёлҰ¬кі S. mutansмҷҖ 4к°Җм§Җмқҳ лӢЁмқј нҒҙлЎ н•ӯмІҙ л°ҳмқ‘ к°„мқҳ мғҒкҙҖкҙҖкі„лҘј мӮҙнҺҙліҙкё° мң„н•ҙ Spearman мғҒкҙҖ분м„қмқ„ мӢӨмӢңн•ҳмҳҖмңјл©°, кө°м—җ л”°лҘё к°Ғ мӢӨн—ҳ кІ°кіјл“Өмқҳ м°Ёмқҙм—җ лҢҖн•ҙ Chi-square кІҖм •, One-way ANOVAлҘј мӢӨмӢңн•ҳмҳҖлӢӨ. 비лӘЁмҲҳм Ғмқё л°©лІ•мңјлЎң FisherвҖҷs Exact test, Kruskal-Wallis testлҘј мӢӨмӢңн•ҳмҳҖлӢӨ.
мЎ°мӮ¬лҢҖмғҒмһҗмқҳ н‘ңліё кө¬м„ұкіј нҠ№м„ұмқ„ мӮҙнҺҙліҙкё° мң„н•ҙ л№ҲлҸ„분м„қмқ„ мӢӨмӢңн•ң кІ°кіј Table 2мҷҖ к°ҷмқҙ лӮҳнғҖлӮ¬лӢӨ. м—°кө¬ лҢҖмғҒмһҗлҠ” мҙқ 97лӘ…мқҙм—Ҳмңјл©°, 1кө° көҗм •нҷҳмһҗ 32.0%, 2кө° мҙҲл“ұн•ҷмғқ 25.8%, 3кө° м„ұмқё 42.3%мқҙм—Ҳкі , к°Ғ кө°мқҳ DMFTлҠ” 5.16, 5.12, 8.39лЎң лӮҳнғҖлӮ¬мңјл©°, м „мІҙ DMFT нҸүк· мқҖ 6.52лЎң мЎ°мӮ¬лҗҳм—ҲлӢӨ(Table 2).
1кө°мқҳ DentocultВ®-SM strip mutansлҘј мқҙмҡ©н•ң colony density (CFU/mL) мЎ°мӮ¬м—җм„ң grade 0мқҙ 10лӘ…(32.3%), grade 1мқҙ 16лӘ…(51.6%), grade 2к°Җ 4лӘ…(12.9%), grade 3мқҙ 1лӘ…(3.2%)мңјлЎң лӮҳнғҖлӮ¬мңјл©°, 2кө°лҠ” grade 0мқҙ 11лӘ…(44.0%), grade 1мқҙ 11лӘ…(44.0%), grade 2к°Җ 2лӘ…(8.0%), grade 3мқҙ 1лӘ…(4.0%)мңјлЎң лӮҳнғҖлӮ¬кі , 3кө°мқҖ grade 0мқҙ 18лӘ…(43.9%), grade 1мқҙ 16лӘ…(39.0%), grade 2к°Җ 6лӘ…(14.6%), grade 3мқҙ 1лӘ…(2.4%)мңјлЎң лӮҳнғҖлӮ¬лӢӨ. м „мІҙ м—°кө¬лҢҖмғҒмһҗмқҳ DentocultВ®-SM strip mutansлҠ” grade 0мқҙ 39лӘ…(40.2%), grade 1мқҙ 43лӘ…(44.3%), grade 2к°Җ 12лӘ…(12.4%), grade 3мқҙ 3лӘ…(3.1%)мңјлЎң лӮҳнғҖлӮ¬лӢӨ(Table 3).
1кө°мқҳ нғҖм•Ўмқ„ мқҙмҡ©н•ң S. mutansм—җ лҢҖн•ң PCR кІ°кіј, S. mutansк°Җ кІҖм¶ңлҗҳм§Җ м•ҠмқҖ кІҪмҡ°к°Җ 61.29%, кІҖм¶ңлҗң кІҪмҡ°к°Җ 38.71%лЎң лӮҳнғҖлӮ¬мңјл©°, S. sobrinusм—җ лҢҖн•ң PCR кІ°кіјлҠ” S. sobrinusк°Җ кІҖм¶ңлҗҳм§Җ м•ҠмқҖ кІҪмҡ°к°Җ 58.65%, кІҖм¶ңлҗң кІҪмҡ°к°Җ 41.94%лЎң лӮҳнғҖлӮ¬кі , S. mutansмҷҖ S. sobrinusк°Җ кіөнҶөмңјлЎң кІҖм¶ңлҗң кІҪмҡ°лҠ” 80.65%, л‘ҳ лӢӨ кІҖм¶ңлҗҳм§Җ м•ҠмқҖ кІҪмҡ°лҠ” 19.35%лЎң лӮҳнғҖлӮ¬лӢӨ. 2кө°мқҳ нғҖм•Ўмқ„ мқҙмҡ©н•ң S. mutansм—җ лҢҖн•ң PCR кІ°кіј, S. mutansк°Җ кІҖм¶ңлҗҳм§Җ м•ҠмқҖ кІҪмҡ°к°Җ 44%, кІҖм¶ңлҗң кІҪмҡ°к°Җ 56%лЎң лӮҳнғҖлӮ¬мңјл©°, S. sobrinusм—җ лҢҖн•ң PCR кІ°кіјлҠ” S. sobrinusк°Җ кІҖм¶ңлҗҳм§Җ м•ҠмқҖ кІҪмҡ°к°Җ 36%, кІҖм¶ңлҗң кІҪмҡ°к°Җ 64%лЎң лӮҳнғҖлӮ¬кі , S. mutansмҷҖ S. sobrinusк°Җ кіөнҶөмңјлЎң кІҖм¶ңлҗң кІҪмҡ°лҠ” 72%, л‘ҳ лӢӨ кІҖм¶ңлҗҳм§Җ м•ҠмқҖ кІҪмҡ°лҠ” 28%лЎң лӮҳнғҖлӮ¬лӢӨ. 3кө°мқҳ нғҖм•Ўмқ„ мқҙмҡ©н•ң S. mutansм—җ лҢҖн•ң PCR кІ°кіј, S. mutansк°Җ кІҖм¶ңлҗҳм§Җ м•ҠмқҖ кІҪмҡ°к°Җ 41.46%, кІҖм¶ңлҗң кІҪмҡ°к°Җ 58.54%лЎң лӮҳнғҖлӮ¬мңјл©°, S. sobrinusм—җ лҢҖн•ң PCR кІ°кіјлҠ” S. sobrinusк°Җ кІҖм¶ңлҗҳм§Җ м•ҠмқҖ кІҪмҡ°к°Җ 65.85%, кІҖм¶ңлҗң кІҪмҡ°к°Җ 34.15%лЎң лӮҳнғҖлӮ¬кі , S. mutansмҷҖ S. sobrinusк°Җ кіөнҶөмңјлЎң кІҖм¶ңлҗң кІҪмҡ°лҠ” 73.17%, л‘ҳ лӢӨ кІҖм¶ңлҗҳм§Җ м•ҠмқҖ кІҪмҡ°лҠ” 26.83%лЎң лӮҳнғҖлӮ¬лӢӨ. м „мІҙ м—°кө¬лҢҖмғҒмһҗл“Өмқҳ S. mutansм—җ лҢҖн•ң PCR кІ°кіј, S. mutansк°Җ кІҖм¶ңлҗҳм§Җ м•ҠмқҖ кІҪмҡ°к°Җ 48.5%, кІҖм¶ңлҗң кІҪмҡ°к°Җ 51.5%лЎң лӮҳнғҖлӮ¬мңјл©°, S. sobrinusм—җ лҢҖн•ң PCR кІ°кіјлҠ” S. sobrinusк°Җ кІҖм¶ңлҗҳм§Җ м•ҠмқҖ кІҪмҡ°к°Җ 55.7%, кІҖм¶ңлҗң кІҪмҡ°к°Җ 44.3%лЎң лӮҳнғҖлӮ¬кі , S. mutansмҷҖ S. sobrinusк°Җ кіөнҶөмңјлЎң кІҖм¶ңлҗң кІҪмҡ°лҠ” 24.7%, л‘ҳ лӢӨ кІҖм¶ңлҗҳм§Җ м•ҠмқҖ кІҪмҡ°лҠ” 75.3%лЎң лӮҳнғҖлӮ¬лӢӨ(Fig. 1-3, Table 4).
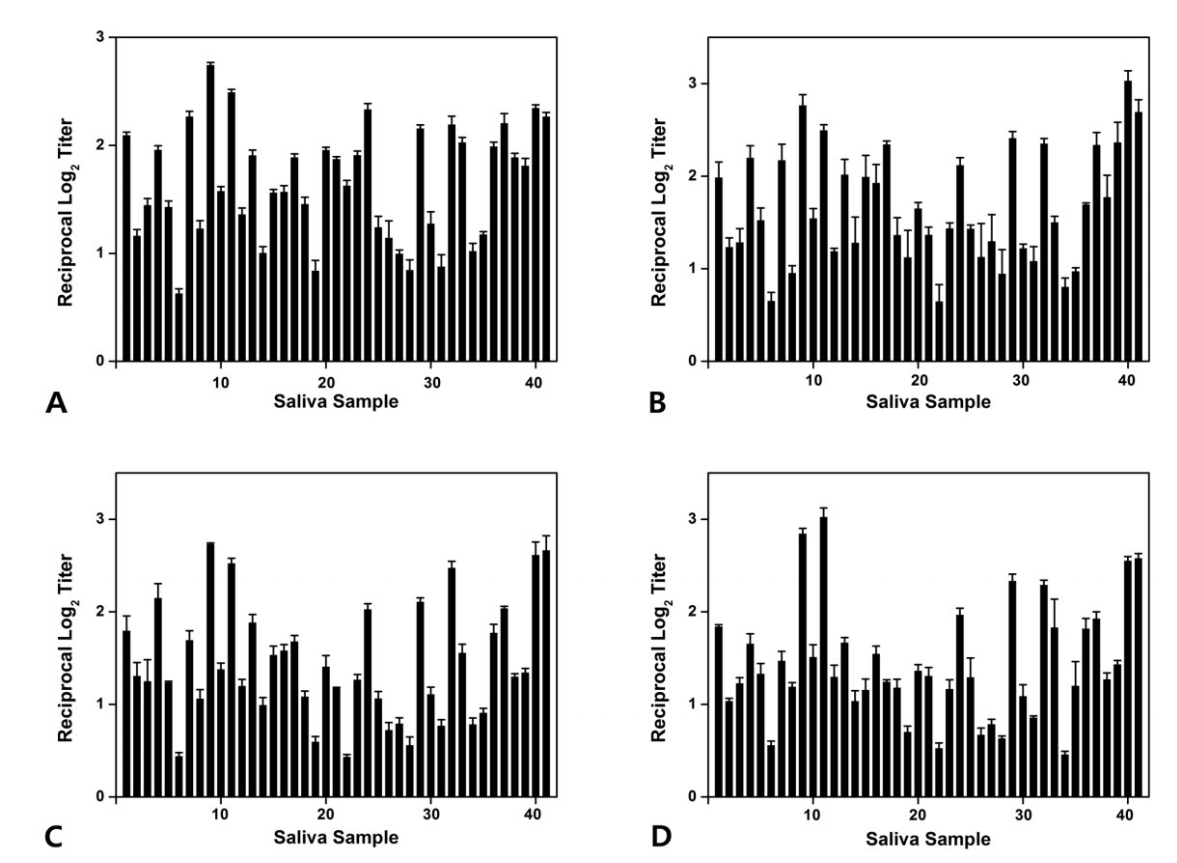
ELISAлҘј мӮ¬мҡ©н•ҳм—¬ нғҖм•Ўкіј к°ңл°ңлҗң 4к°Җм§Җ лӢЁмқјнҒҙлЎ н•ӯмІҙ(ckAg I/II, ckBN, ckCN, ckDN)лҘј л°ҳмқ‘мӢңмјң нғҖм•Ў лӮҙ S. mutansлҘј кІҖм¶ңн•ҳмҳҖлӢӨ. 1кө°м—җм„ң ckAg I/IIмқҖ нҸүк· 1.78, ckBNмқҖ нҸүк· 1.97, ckCNмқҖ нҸүк· 1.86, ckDNмқҖ нҸүк· 1.55лЎң кІҖм¶ңлҗҳм—Ҳмңјл©°, 2кө°м—җм„ң ckAg I/IIмқҖ нҸүк· 1.70, ckBNмқҖ нҸүк· 1.82, ckCNмқҖ нҸүк· 1.57, ckDNмқҖ нҸүк· 1.70лЎң кІҖм¶ңлҗҳм—Ҳкі , 3кө°м—җм„ң ckAg I/IIмқҖ нҸүк· 1.65, ckBNмқҖ нҸүк· 1.67, ckCNмқҖ нҸүк· 1.44, ckDNмқҖ нҸүк· 1.44лЎң кІҖм¶ңлҗҳм—ҲлӢӨ. м „мІҙ м—°кө¬лҢҖмғҒмһҗл“Өм—җм„ңлҠ” ckAg I/IIмқҖ нҸүк· 1.71, ckBNмқҖ нҸүк· 1.80, ckCNмқҖ нҸүк· 1.61, ckDNмқҖ нҸүк· 1.54лЎң кІҖм¶ңлҗҳм—ҲлӢӨ(Fig. 4-6, Table 5).
ліё м—°кө¬мқҳ ліҖмҲҳ к°„ кҙҖл Ём„ұмқ„ мӮҙнҺҙліҙкё° мң„н•ҳм—¬ Spearman мғҒкҙҖ분м„қмқ„ мӢңн–үн•ң кІ°кіј, DentocultВ®-SM strip mutans (DSM)лҘј мқҙмҡ©н•ң мӢӨн—ҳмқҖ polymerase chain reaction-Streptococcus mutans (PCR-SM) (r = 0.295, p < 0.01), polymerase chain reaction-Streptococcus sobrinus (PCR-SS) (r = 0.369, p < 0.001), PCR-Both (r = 0.467, p < 0.001)м—җ м–‘(+)мқҳ мң мқҳн•ң мҳҒн–Ҙмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬лӢӨ. PCR-SMмқҖ PCR-Both (r = 0.585, p < 0.001)м—җ м–‘(+)мқҳ мң мқҳн•ң мҳҒн–Ҙмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬мңјл©°, PCR-SSлҠ” PCR-Both (r =0.643, p < 0.001)м—җ м–‘(+)мқҳ мң мқҳн•ң мҳҒн–Ҙмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬лӢӨ. ckAg I/II levelмқҖ ckBN (r = 0.811, p < 0.001), ckCN (r = 0.753, p < 0.001), ckDN (r = 0.834, p < 0.001)м—җ м–‘(+)мқҳ мң мқҳн•ң мҳҒн–Ҙмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬мңјл©°, ckBNмқҖ ckCN (r = 0.823, p < 0.001), ckDN (r = 0.825, p < 0.001)м—җ м–‘(+)мқҳ мң мқҳн•ң мҳҒн–Ҙмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬кі , ckCNмқҖ ckDN (r = 0.751, p < 0.001)м—җ м–‘(+)мқҳ мң мқҳн•ң мҳҒн–Ҙмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬лӢӨ.
1кө°мқҳ ліҖмҲҳ к°„ кҙҖл Ём„ұмқ„ мӮҙнҺҙліҙкё° мң„н•ҳм—¬ Spearman мғҒкҙҖ분м„қмқ„ мӢңн–үн•ң кІ°кіј, D-SMмқ„ мқҙмҡ©н•ң мӢӨн—ҳмқҖ PCR-SM (r = 0.510, p < 0.01), PCR-Both (r = 0.492, p < 0.01)м—җ м–‘(+)мқҳ мң мқҳн•ң мҳҒн–Ҙмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬лӢӨ. PCR-SMмқҖ PCR-Both (r = 0.661, p < 0.001)м—җ м–‘(+)мқҳ мң мқҳн•ң мҳҒн–Ҙмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬мңјл©°, ckAg I/II (r = - 0.554, p < 0.01), ckBN (r = - 0.534, p < 0.01), ckDN (r = - 0.434, p < 0.05)м—җ мқҢ(-)мқҳ мң мқҳн•ң мҳҒн–Ҙмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬кі , PCR-SSлҠ” PCR-Both (r = 0.576, p < 0.01)м—җ м–‘(+)мқҳ мң мқҳн•ң мҳҒн–Ҙмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬лӢӨ. ckAg I/IIлҠ” ckBN (r = 0.841, p < 0.001), ckCN (r = 0.629, p < 0.001), ckDN (r = 0.853, p < 0.001)м—җ м–‘(+)мқҳ мң мқҳн•ң мҳҒн–Ҙмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬мңјл©°, ckBNмқҖ ckCN (r = 0.662, p < 0.001), ckDN (r = 0.822, p < 0.001)м—җ м–‘(+)мқҳ мң мқҳн•ң мҳҒн–Ҙмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬кі , ckCNмқҖ ckDN (r = 0.614, p < 0.001)м—җ м–‘(+)мқҳ мң мқҳн•ң мҳҒн–Ҙмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬лӢӨ.
2кө°мқҳ ліҖмҲҳ к°„ кҙҖл Ём„ұмқ„ мӮҙнҺҙліҙкё° мң„н•ҳм—¬ Spearman мғҒкҙҖ분м„қмқ„ мӢңн–үн•ң кІ°кіј, DMFTлҠ” D-SM (r = 0.416, p < 0.05)м—җ м–‘(+)мқҳ мң мқҳн•ң мҳҒн–Ҙмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬мңјл©°, D-SMмқҖ PCR-SS (r = 0.460, p < 0.05), PCR-Both (r = 0.576, p < 0.01), ckAg I/II (r = 0.488, p < 0.05)м—җ м–‘(+)мқҳ мң мқҳн•ң мҳҒн–Ҙмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬лӢӨ. PCR-SMмқҖ PCR-Both (r = 0.599, p < 0.01), ckBN (r = 0.433, p < 0.05)м—җ м–‘(+)мқҳ мң мқҳн•ң мҳҒн–Ҙмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬мңјл©°, PCR-SSлҠ” PCR-Both (r = 0.509, p < 0.01)м—җ м–‘(+)мқҳ мң мқҳн•ң мҳҒн–Ҙмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬кі , PCR-BothлҠ” ckBN (r = 0.494, p < 0.05)м—җ м–‘(+)мқҳ мң мқҳн•ң мҳҒн–Ҙмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬лӢӨ. ckAg I/IIлҠ” ckBN (r = 0.686, p < 0.001), ckCN (r = 0.723, p < 0.001), ckDN (r = 0.688, p < 0.001)м—җ м–‘(+)мқҳ мң мқҳн•ң мҳҒн–Ҙмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬мңјл©°, ckBNмқҖ ckCN (r = 0.781, p < 0.001), ckDN (r = 0.801, p < 0.001)м—җ м–‘(+)мқҳ мң мқҳн•ң мҳҒн–Ҙмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬кі , ckCNмқҖ ckDN (r = 0.676, p < 0.001)м—җ м–‘(+)мқҳ мң мқҳн•ң мҳҒн–Ҙмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬лӢӨ.
3кө°мқҳ ліҖмҲҳ к°„ кҙҖл Ём„ұмқ„ мӮҙнҺҙліҙкё° мң„н•ҳм—¬ Spearman мғҒкҙҖ분м„қмқ„ мӢңн–үн•ң кІ°кіј, D-SMмқҖ PCR-SM (r = 0.453, p < 0.01), PCR-SS (r = 0.417, p < 0.01), PCR-Both (r = 0.514, p < 0.01)м—җ м–‘(+)мқҳ мң мқҳн•ң мҳҒн–Ҙмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬лӢӨ. PCR-SMмқҖ PCR-Both (r = 0.528, p < 0.001)м—җ м–‘(+)мқҳ мң мқҳн•ң мҳҒн–Ҙмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬мңјл©°, PCR-SSлҠ” PCR-Both (r = 0.797, p < 0.001)м—җ м–‘(+)мқҳ мң мқҳн•ң мҳҒн–Ҙмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬лӢӨ. ckAg I/IIлҠ” ckBN (r = 0.856, p < 0.001), ckCN (r = 0.902, p < 0.001), ckDN (r = 0.885, p < 0.001)м—җ м–‘(+)мқҳ мң мқҳн•ң мҳҒн–Ҙмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬мңјл©°, ckBNмқҖ ckCN (r = 0.933, p < 0.001), ckDN (r = 0.868, p < 0.001)м—җ м–‘(+)мқҳ мң мқҳн•ң мҳҒн–Ҙмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬кі , ckCNмқҖ ckDN (r = 0.922, p < 0.001)м—җ м–‘(+)мқҳ мң мқҳн•ң мҳҒн–Ҙмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬лӢӨ.
кө°м—җ л”°лҘё ліҖмҲҳл“Өмқҳ м°ЁмқҙлҘј мӮҙнҺҙліҙкё° мң„н•ҙ Chi-square кІҖм •, One-way ANOVAлҘј мӢӨмӢңн•ң кІ°кіј, кө°м—җ л”°лқј DMFT, PCR-SM, ckCNм—җм„ң нҶөкі„м ҒмңјлЎң мң мқҳн•ң м°Ёмқҙк°Җ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬мңјл©°(p < 0.05), 비лӘЁмҲҳм Ғ л°©лІ•мқё FisherвҖҷs Exact test, Kruskal-Wallis testлҘј мӢңн–үн•ң кІ°кіј DMFT, PCR-SM, ckCNм—җм„ң нҶөкі„м ҒмңјлЎң мң мқҳн•ң м°Ёмқҙк°Җ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬лӢӨ(p < 0.05). DMFTм—җм„ң 3кө°(Mean = 8.39)мқҙ 1кө°(Mean = 5.16), 2кө°(Mean = 5.12)ліҙлӢӨ лҶ’мқҖ кІғмңјлЎң лӮҳнғҖлӮ¬лӢӨ. PCR-SMлҠ” 1кө°м—җм„ң л¶ҲкІҖм¶ң 61.3%, 2кө°м—җм„ң кІҖм¶ң 52.0%, 3кө°м—җм„ң кІҖм¶ң 48.8%лЎң лҶ’кІҢ лӮҳнғҖлӮ¬лӢӨ. ckCNм—җм„ң 1кө°(Mean = 1.86)мқҙ 2кө°(Mean = 1.57), 3кө°(Mean = 1.44)ліҙлӢӨ лҶ’мқҖ кІғмңјлЎң лӮҳнғҖлӮ¬лӢӨ.
м№ҳм•„ мҡ°мӢқмқҳ н•ҙкІ°кіј мҳҲл°©мқ„ мң„н•ҳм—¬ к·ёлҸҷм•Ҳ л§ҺмқҖ м—°кө¬л“Өмқҙ мқҙлЈЁм–ҙмЎҢлӢӨ. мҡ°мӢқ нҳ•м„ұ мҡ”мқёл“Ө мӨ‘, лҜёмғқл¬јмқҖ к°ҖмһҘ мӨ‘мҡ”н•ң мқёмһҗлЎң 여겨진лӢӨ. мӮ¬лһҢм—җм„ң л§Һмқҙ л°ңкІ¬лҗҳлҠ” м№ҳм•„мҡ°мӢқк· мңјлЎңлҠ” S. mutansмҷҖ S. sorbinusк°Җ мһҲмңјл©°, мқҙ л‘җ м„ёк· мқҙ лҸҷмӢңм—җ м¶ңнҳ„н• кІҪмҡ°, нғҖм•Ў лӮҙ mutans streptococciмқҳ мҲҳк°Җ лҶ’кІҢ лӮҳнғҖлӮҳкі [10] м№ҳм•„мҡ°мӢқмҰқмқҙ лҚ” мӢ¬н•ҳкІҢ лӮҳнғҖлӮҳлҠ” кІҪн–Ҙмқҙ мһҲлӢӨ[11]. к·ё мӨ‘ S. mutansк°Җ S. sorbinusм—җ 비н•ҙ, м„ёк· мқҙ м№ҳм•„м—җ мІҳмқҢ л¶Җм°©н• л•Ң мҡ”кө¬лҗҳлҠ” нҠ№лі„н•ң м„ёнҸ¬ н‘ңл©ҙ лӢЁл°ұм§Ҳмқҙ н’Қл¶Җн•ҳкё° л•Ңл¬ём—җ мҡ°мӢқ нҳ•м„ұлҠҘмқҙ лҚ” нҒ¬лӢӨкі л°қнҳҖмЎҢлӢӨ[12].
S. mutansмқҳ мҙҲкё° л¶Җм°©мқҖ м„ёнҸ¬ н‘ңл©ҙмқҳ л¶Җм°© лӢЁл°ұм§Ҳ(Agв… /в…Ў)м—җ мқҳн•ҙ мқҙлЈЁм–ҙ진лӢӨ. мқҙ лӢЁл°ұм§ҲмқҖ м„ёк· мқҙ м№ҳм•„ н‘ңл©ҙм—җ л¶Җм°©н•ҳлҠ” кІғмқ„ лҸ•кі , лҚ” л§ҺмқҖ л¶Җм°©мқҙ мқҙлЈЁм–ҙм§ҖлҸ„лЎқ л¶Җм°©л¶Җмң„лҘј м ңкіөн•ҳкё°лҸ„ н•ңлӢӨ[13]. мөңк·јмқҳ м—°кө¬м—җм„ң, мқҙ лӢЁл°ұм§Ҳмқ„ м–өм ңмӢңнӮӨмһҗ S. mutansмқҳ лҸ…м„ұмқҙ к°җмҶҢлҗҳм—ҲлӢӨ[14]. м№ҳл©ҙм—җ мҙҲкё° л¶Җм°© нӣ„, S. mutansлҠ” sucroseлҘј мқҙмҡ©н•ҳм—¬ мҲҳмҡ©м„ұкіј л¶ҲмҲҳмҡ©м„ұмқҳ glucanмқ„ н•©м„ұн•ҳлҠ”лҚ°, мқҙлҹ¬н•ң кіјм •мқҖ gtfs нҡЁмҶҢ(gtf-B, gtf-C, gtf-D)м—җ мқҳн•ҙ мқҙлЈЁм–ҙ진лӢӨ. мқҙ нҡЁмҶҢл“ӨмқҖ glucan н•©м„ұмқҳ л§Ҳм§Җл§үм—җ кёҖлЈЁмҪ”мӢӨкё° мқјл¶ҖлҘј м „мқҙмӢңмјң лҚ§л¶ҷмқҙлҠ” кіјм •мқ„ мҙү진н•ҳкі , мқҙл ҮкІҢ л§Ңл“Өм–ҙ진 кёҖлЈЁм№ёмқҳ м җм°©м„ұмқҖ м№ҳм•„м—җ м„ёк· мқҳ л¶Җм°©мқ„ мҡ©мқҙн•ҳкІҢ н•ңлӢӨ. к·ёлҰ¬кі S. mutansлҠ” кёҖлЈЁм№ёкіј кІ°н•©н•ҳлҠ” лӢЁл°ұм§Ҳл“Ө(GBPs)мқ„ л§Ңл“ңлҠ”лҚ°, мқҙкІғмқҖ sucrose-dependent лӢЁкі„м—җм„ң м„ёк· мқҳ л¶Җм°©мқ„ лҸ•лҠ”лӢӨ[15]. лҳҗн•ң S. mutansлҠ” fructosyltransferase (FTF)лҘј мқҙмҡ©н•ҳм—¬ fructanмқ„ н•©м„ұн•ҳлҠ”лҚ°, fructanмқҖ м„ёнҸ¬мҷё м ҖмһҘкі лЎңм„ңмқҳ м—ӯн• мқ„ н•ҳлҠ” кІғмңјлЎң м—¬кІЁм§Җл©°, м№ҳнғңмғқм„ұм—җ кҙҖм—¬н•ҳлҠ” кІғмңјлЎң м•Ңл Өм ё мһҲлӢӨ[16]. м„ёнҸ¬мҷё glucoseмҷҖ sucroseк°Җ мһҲмқ„ л•Ң S. mutansлҠ” glycogenкіј 비мҠ·н•ң м„ёнҸ¬лӮҙ лӢӨлӢ№лҘҳ(innerpolysaccharides, IPSs)лҘј л§Ңл“ңлҠ”лҚ°, мқҙкІғмқҖ мҷёл¶Җм—җ нғ„мҲҳнҷ”л¬јмқҙ м—Ҷмқ„ л•Ң лҢҖмӮ¬лҗҳм–ҙ мӮ°мқҳ мғқм„ұмқ„ мң лҸ„н•ңлӢӨ[15]. S. mutansмқҳ м„ёнҸ¬л§үм—җ мһҲлҠ” ATPaseлҠ” м„ёк· мңјлЎңл¶Җн„° H+мқҙмҳЁмқҳ pumpingмқ„ лҸ„мҷҖ м„ёнҸ¬ лӮҙ мӮ°м„ұнҷ”лҘј к°җмҶҢмӢңмјң мЈјмң„мқҳ лӮ®мқҖ pHнҷҳкІҪм—җм„ңлҸ„ м„ёк· мқҙ кё°лҠҘн• мҲҳ мһҲлҸ„лЎқ н•ңлӢӨ[17]. S. mutansмқҳ н•ӯм„ёк· л¬јм§Ҳмқё mutacinмқҖ лӢӨлҘё мў…лҘҳмқҳ mutans streptococciмҷҖ mutans streptococciк°Җ м•„лӢҢ к·ёлһҢм–‘м„ұ м„ёк· л“Өмқҳ м„ұмһҘмқ„ л°©н•ҙн•ңлӢӨ. мқҙлҹ° кіјм •мқ„ нҶөн•ҙ кІ°көӯ mutacinмқҖ кө¬к°• лӮҙм—җм„ң S. mutansк°Җ нҡЁкіјм ҒмңјлЎң м •м°©н•ҳм—¬ 집лқҪмқ„ мқҙлЈЁлҸ„лЎқ лҸ•лҠ”лӢӨ[16]. мқҙлҹ¬н•ң лӢЁкі„м Ғмқё м№ҳм•„мҡ°мӢқмҰқмқҳ лі‘мқё кіјм •мқ„ л§үлҠ” кІғмқҙ, м№ҳм•„мҡ°мӢқмҰқмқ„ мҳҲл°©н•ҳкұ°лӮҳ м№ҳлЈҢн•ҳлҠ” м—°кө¬мқҳ мЈјмҡ”н•ң кіјм ңк°Җ лҗ кІғмқҙлӢӨ.
лҳҗн•ң кө¬к°• лӮҙ м„ёк· мқҳ 집лқҪ нҳ•м„ұм—җлҠ” нҷҳкІҪм Ғмқё мғҒнҳё мһ‘мҡ©мқҙ мӨ‘мҡ”н•ҳлӢӨ. мһҗм—° л©ҙм—ӯл°ҳмқ‘мқҙ мқјм–ҙлӮҳлҚ”лқјлҸ„ кіјлӢӨн•ң нғ„мҲҳнҷ”л¬јм—җ л…ём¶ңлҗҳкұ°лӮҳ л©ҙм—ӯн•ҷм ҒмңјлЎң мқҙмғҒмқҙ мһҲмңјл©ҙ, mutans streptococciк°Җ мҡ°м„ён•ҙ м§Ҳ кІғмқҙлӢӨ[18]. л”°лқјм„ң м№ҳм•„мҡ°мӢқмҰқмқ„ мҳҲл°©н•ҳкё° мң„н•ҙм„ң лҠ” IgGлҘј нҶөн•ң л©ҙм—ӯ л°ҳмқ‘мқҙлӮҳ S-IgAлҘј мқҙмҡ©н•ҳм—¬ м„ёк· м§‘лқҪ нҳ•м„ұмқ„ мЎ°м Ҳн•ҳлҠ” кІғмқҙ мӨ‘мҡ”н•ҳлӢӨ.
к·ё мӨ‘ мҡ°мӢқмқ„ м•јкё°н•ҳлҠ” mutans streptococciм—җ лҢҖн•ң л©ҙм—ӯ л°©м–ҙлҠ” мЈјлЎң нғҖм•Ўм—җм„ң 분비лҗҳлҠ” IgA н•ӯмІҙм—җ мқҳн•ҙ мқҙлЈЁм–ҙм§ҖлҠ”лҚ° мқҙ н•ӯмІҙлҠ” м„ёк· мқҳ мҷёлҸ…мҶҢлӮҳ м§Ҳлі‘мқ„ мқјмңјнӮӨлҠ” нҡЁмҶҢ л°Ҹ л°”мқҙлҹ¬мҠӨ л“ұмқ„ мӨ‘нҷ”мӢңнӮӨкі , мӮ° мғқм„ұмқ„ л°©н•ҙн•ҳл©°, м№ҳм•„лӮҳ кө¬к°• м җл§ү н‘ңл©ҙм—җ м„ёк· мқҙ л¶Җм°©н•ҳлҠ” кІғмқ„ л°©н•ҙн•ңлӢӨ[19]. нғҖм•Ў лӮҙ н•ӯмғқ л¬јм§Ҳ(lysozyme, lactoferrin, lactoperoxidase л“ұ)мқҳ нҡЁкіјлҘј лҚ”мҡұ мҰқк°ҖмӢңнӮӨлҠ” S-IgAмқҳ нҡЁкіј л•Ңл¬ём—җ, S. mutansм—җ лҢҖн•ң S-IgAмқҳ л°ҳмқ‘мқ„ мҰқк°ҖмӢңнӮӨлҠ” л°©н–ҘмңјлЎң л°ұмӢ к°ңл°ңмқҙ мқҙлЈЁм–ҙм§Җкі мһҲлӢӨ[20]. S. mutansмқҳ Agв… /в…ЎмҷҖ gtfsлҘј мЎ°н•©н•ң мәЎмҠҗлЎң лҠҘлҸҷ л©ҙм—ӯнҷ” н•ң мӢӨн—ҳм—җм„ң S-IgA н•ӯмІҙмқҳ мҰқк°Җк°Җ м„ұкіөм ҒмңјлЎң лӮҳнғҖлӮ¬лӢӨ[21]. к·ёлҹ¬лӮҳ лҠҘлҸҷ л©ҙм—ӯм—җм„ң м•јкё°лҗ мҲҳ мһҲлҠ” мң„н—ҳм„ұ л•Ңл¬ём—җ, м№ҳм•„мҡ°мӢқмҰқм—җ лҢҖн•ҙ мҲҳлҸҷ л©ҙм—ӯмңјлЎң кө¬к°•м—җ м Ғмҡ© к°ҖлҠҘн•ң н•ӯмІҙ к°ңл°ңмқҙ лҢҖм•ҲмңјлЎң м ңмӢңлҗҳкі мһҲлӢӨ[22]. S. mutansмқҳ н•ӯмӣҗм—җ лҢҖн•ҙ к°ңл°ңлҗң н•ӯмІҙмҷҖ мң м „м ҒмңјлЎң к°Җкіөлҗң мқёк°„нҷ” S-IgA н•ӯмІҙлҘј мқҙмҡ©н•ң м—°кө¬м—җм„ң, к°ңл°ңлҗң лӢЁмқјнҒҙлЎ н•ӯмІҙлҘј м Ғмҡ©н–Ҳмқ„ л•Ң, S. mutansмқҳ мһ¬м¶ңнҳ„мқҙ мқјм •кё°к°„ м–өм ңлҗҳм—ҲмңјлӮҳ лҚ” л§ҺмқҖ мӢӨн—ҳм°ёк°Җмһҗл“Өмқ„ лҢҖмғҒмңјлЎң н•ң мӢӨн—ҳм—җм„ңлҠ” лҸҷмқјн•ң кІ°кіјк°Җ лӮҳнғҖлӮҳм§Җ м•Ҡм•ҳлӢӨ[23]. н•ҳм§Җл§Ң мқҙлҹ¬н•ң м—°кө¬л“ӨмқҖ н•ӯмІҙмқҳ mutans streptococci 집лқҪ нҳ•м„ұмқ„ л°©н•ҙн•ҳлҠ” лҠҘл Ҙмқ„ мҰқлӘ…н•ң кІғм—җ нҒ° мқҳмқҳк°Җ мһҲмңјл©°, н–Ҙнӣ„ мқҙлҘј л°”нғ•мңјлЎң лӢЁмқјнҒҙлЎ н•ӯмІҙлҘј мқҙмҡ©н•ҳм—¬ S. mutansм—җ мқҳн•ң м№ҳнғң нҳ•м„ұ м–өм ңм—җ лҢҖн•ң м—°кө¬к°Җ мҡ”кө¬лҗңлӢӨ.
мҡ°мӢқ мң„н—ҳлҸ„к°Җ лҶ’мқҖ нҷҳмһҗлҘј мӢқлі„н•ҳкі мҳҲл°©н•ҳкё° мң„н•ҙ лӢЁмқјнҒҙлЎ н•ӯмІҙлҘј мқҙмҡ©н•ҳм—¬ нғҖм•Ў лӮҙ S. mutansмқҳ м–‘мқ„ 1분 мқҙлӮҙм—җ лӮҳнғҖлӮҙлҠ” м—°кө¬к°Җ л°ңн‘ңлҗҳм—Ҳкі , мөңк·јм—җлҠ” Saliva-checkв„ў mutans (GC, Tokyo, Japan)лқјлҠ” м ңн’ҲлҸ„ мғҒмҡ©нҷ”лҗҳм—ҲлӢӨ[24]. мқҙлҠ” S. mutansмқҳ мЎҙмһ¬мң л¬ҙ нҢҗм •л§Ңмқҙ мқҙлЈЁм–ҙ진лӢӨлҠ” м җкіј кі л№„мҡ©мқҙ н•ңкі„м җмңјлЎң м§Җм Ғлҗҳкё°лҠ” н•ҳлӮҳ, м„ёк· мқҳ л°°м–‘кё°к°„мқҙ н•„мҡ”н•ҳм§Җ м•Ҡкё° л•Ңл¬ём—җ кІ°кіјлҘј мӢ мҶҚн•ҳкІҢ м•Ң мҲҳ мһҲмңјл©° мӮ¬мҡ©лІ•мқҙ к°„лӢЁн•ҳлӢӨлҠ” мһҘм җмқҙ мһҲлӢӨ[25,26]. к·ё л°–м—җлҸ„ лӢЁмқјнҒҙлЎ н•ӯмІҙмҷҖ нғҖм•Ў лӮҙ S. mutansлҘј нҷңмҡ©н•ҳм—¬ м№ҳм•„мҡ°мӢқмҰқмқ„ мҳҲмёЎн•ҳкі мҳҲл°©н•ҳкё° мң„н•ң м—¬лҹ¬ м—°кө¬л“Өмқҙ м§ҖмҶҚлҗҳкі мһҲмңјлӮҳ м•„м§Ғ нҡҚкё°м Ғмқё мғҒн’Ҳмқҳ к°ңл°ңмқҙ мқҙлЈЁм–ҙм§Җм§Җ м•Ҡкі мһҲлҠ” кІғмқҙ нҳ„мӢӨмқҙлӢӨ[27]. л”°лқјм„ң м№ҳм•„мҡ°мӢқмҰқм—җ мҳҒн–Ҙмқ„ мӨ„ мҲҳ мһҲлҠ” м—¬лҹ¬ мҡ”мҶҢл“Өмқҳ мЎ°м Ҳкіј лҚ” л§ҺмқҖ м—°кө¬лҘј нҶөн•ҙ, кІҪм ңм Ғмқҙкі л№ лҘҙкі к°„нҺён•ҳл©° м •лҹүм Ғмқё лҢҖлҹү кІҖм¶ңлІ•кіј м№ҳм•„ мҡ°мӢқ л°ұмӢ мқҳ мғҒмҡ©нҷ”к°Җ мқҙлЈЁм–ҙ진лӢӨл©ҙ м№ҳм•„мҡ°мӢқмҰқмқ„ мҳҲл°©н•ҳлҠ”лҚ° мһҲм–ҙм„ң мғҒлӢ№н•ң лҸ„мӣҖмқҙ лҗ мҲҳ мһҲмқ„ кІғмңјлЎң мғқк°ҒлҗңлӢӨ.
мқҙм—җ ліё м—°кө¬м—җм„ңлҠ” S. mutansмқҳ мҙҲкё° лі‘мқёлЎ м—җ мӨ‘мҡ”н•ң м—ӯн• мқ„ н•ҳлҠ” Ag I/II лӢЁл°ұм§Ҳкіј gtfsм—җ лҢҖн•ҙ к°ңл°ңлҗң лӢЁмқјнҒҙлЎ н•ӯмІҙл“Өмқ„ мӮ¬мҡ©н•ҳм—¬, нғҖм•Ў лӮҙ S. mutansлҘј кІҖм¶ңн•ҳкі к·ёл“Өмқҳ м •лһөм Ғ 분м„қмқ„ нҶөн•ҙ лӢЁмқјнҒҙлЎ н•ӯмІҙл“Өмқҳ нҡЁмҡ©м„ұмқ„ нҸүк°Җн•ҳл©°, S. mutansмқҳ мЎҙмһ¬ м—¬л¶ҖлҘј нҷ•мқён•ҳкё° мң„н•ң мёЎм • м ңн’ҲмңјлЎңм„ңмқҳ к°ңл°ң м—°кө¬ к°ҖлҠҘм„ұмқ„ ліҙм•ҳлӢӨ. м—°кө¬ лҢҖмғҒмқё м„ё кө°м—җм„ң DMFT, DentocultВ®-SM strip mutansлҘј мқҙмҡ©н•ң colony density (CFU/mL), к·ёлҰ¬кі PCRмқ„ мқҙмҡ©н•ң S. mutansмҷҖ S. sobrinus мЎҙмһ¬м—¬л¶Җмқҳ мғҒкҙҖкҙҖкі„лҘј мЎ°мӮ¬н•ң кІ°кіј, м „мІҙ 97к°ңмІҙ мӨ‘ мҡ°мӢқ кІҪн—ҳм№ҳм•„мҲҳк°Җ 0мқё лҢҖмғҒмқҖ 8лӘ…мқҙм—Ҳмңјл©° к·ё мӨ‘ 1лӘ…м—җм„ң S. mutansк°Җ кІҖм¶ңлҗҳм—Ҳкі (18%), 4лӘ…м—җм„ң S. sobrinusк°Җ кІҖм¶ңлҗҳм—Ҳмңјл©°(50%) лӮҳлЁём§Җ 3лӘ…м—җм„ңлҠ” л‘ҳ лӢӨ кІҖм¶ң лҗҳм§Җ м•Ҡм•ҳлӢӨ(32%). мқҙкІғмқҖ кё°ліём ҒмңјлЎң S. sobrinusк°Җ м№ҳм•„мҡ°мӢқ нҳ•м„ұм—җ нҒ° мҳҒн–Ҙмқ„ мЈјм§Җ м•ҠлҠ” мҡ”мқёмһ„мқ„ мһ…мҰқн•ҳлҠ” кІғмқҙлқј н• мҲҳ мһҲлӢӨ. м„ё кө°мқҖ к°Ғ мӢӨн—ҳл“Ө к°„мқҳ мғҒкҙҖм„ұ мЎ°мӮ¬м—җм„ң мқјл¶Җ мң мқҳн•ң к°’мқ„ ліҙмҳҖмңјлӮҳ лҡңл ·н•ң мғҒкҙҖ кҙҖкі„лҠ” нҷ•мқён• мҲҳ м—Ҷм—ҲлҠ”лҚ° к·ё мӣҗмқёмқ„ кі л Өн•ҙ ліҙмһҗл©ҙ, DMFTмқҳ кІҪмҡ° м№ҳмқҳн•ҷ м—°кө¬ 분야м—җм„ң лӢӨл°©л©ҙмңјлЎң мқҙмҡ©лҗҳкі мһҲмңјлӮҳ мҡ°мӢқм№ҳм•„(decayed teeth, DT), мғҒмӢӨм№ҳм•„(missed teeth, MT), м¶©м „м№ҳм•„(filled teeth, FT)лҘј н•©мӮ°н•ҳлҠ” л°©мӢқмқҙкё° л•Ңл¬ём—җ, нҳ„мһ¬мқҳ S. mutans нҷңлҸҷм„ұмқ„ мёЎм •н•ҳкё°м—җлҠ” м Ғн•©н•ҳм§Җ м•Ҡмқ„ мҲҳ мһҲмңјлҰ¬лқј мғқк°ҒлҗңлӢӨ. DMFSк°Җ лҶ’кұ°лӮҳ DT, MT, FTлҘј л”°лЎң кҙҖм°°н•ң м—°кө¬м—җм„ң DTк°Җ лҶ’мқ„мҲҳлЎқ м„ёк· нҷңм„ұмқҙ лҶ’м•ҳлӢӨлҠ” м—°кө¬ кІ°кіјлҘј лҜёлЈЁм–ҙ ліҙм•ҳмқ„ л•Ң, DMFTк°Җ м—¬м „нһҲ л§ҺмқҖ м—°кө¬м—җм„ң мӮ¬мҡ©лҗҳкі мһҲмңјлӮҳ м •нҷ•лҸ„лҘј лҶ’мқҙкё° мң„н•ҙм„ңлҠ” мӢқмқҙ мЎ°м ҲмқҙлӮҳ м–‘м№ҳм§Ҳ нҡҹмҲҳ мЎ°м Ҳ л“ұмқҳ мўҖ лҚ” м—„кІ©н•ң мЎ°кұҙм—җм„ңмқҳ кҙҖм°°мқҙ н•„мҡ”н•ҳлӢӨ[28].
лӢЁмқјнҒҙлЎ н•ӯмІҙлҘј мӮ¬мҡ©н•ң нғҖм•Ў лӮҙ S. mutans кІҖм¶ңк°’кіј DMFT, DentocultВ®-SM strip mutans, PCR кІ°кіј к°„мқҳ мғҒкҙҖкҙҖкі„лҘј мЎ°мӮ¬н•ҳмҳҖмқ„ л•Ң мӢӨн—ҳ лҢҖмғҒмқҳ DMFT нҸүк· к°’мқҖ 3кө°мқҙ 1, 2кө°м—җ 비н•ҙ лҶ’м•ҳмңјл©° 1кө°кіј 2кө°мқҖ 비мҠ·н•ҳмҳҖлӢӨ. мқҙм—җ л°ҳн•ҙ лӢЁмқјнҒҙлЎ н•ӯмІҙм—җ мқҳн•ҙ мёЎм •лҗң 1, 2, 3кө°мқҳ S. mutansлҠ” мҳӨнһҲл Ө DMFTк°Җ лҶ’мқҖ 3кө°м—җм„ң м „мІҙм ҒмңјлЎң лӢЁмқјн•ӯмІҙм—җ мқҳн•ҙ мёЎм •лҗң м–‘мқҙ м ҒкІҢ лӮҳнғҖлӮ¬лӢӨ. мқҙкІғмқҖ н•ӯмІҙлҘј мёЎм •н•ҳлҠ” л°©лІ•мңјлЎң мұ„нғқлҗң ELISAлҠ” лӢЁмқјнҒҙлЎ н•ӯмІҙлҘј мӮ¬мҡ©н•ҙ м •нҷ•лҸ„лҠ” лҶ’мңјлӮҳ нҠ№м • лӢЁл°ұм§Ҳм—җ лҢҖн•ң н•ӯмІҙмқҳ м—ӯк°Җл§Ңмқ„ мёЎм •н•ҙ м „мІҙм Ғмқё S. mutansмқҳ м–‘мқ„ мёЎм •н•ҳкё°м—җлҠ” м Ғн•©н•ҳм§Җ лӘ»н•ҳлӢӨлҠ” кІғмқ„ ліҙм—¬мӨҖлӢӨ. мҰү, мёЎм •лҗң н•ӯмІҙлҠ” м„ёк· мқҳ нҠ№м • н•ӯмӣҗм—җ лҢҖн•ң н•ӯмІҙмқҳ м–‘мқҙм§Җ S. mutans м „мІҙм—җ лҢҖн•ң н•ӯмІҙмқҳ м–‘мқҙлқјкі н• мҲҳ м—ҶлӢӨлҠ” кІғмқҙлӢӨ[29]. л”°лқјм„ң ліё м—°кө¬м—җм„ң S. mutansмҷҖ лӢЁмқјнҒҙлЎ н•ӯмІҙ л°ҳмқ‘мӢңмјң м–»м–ҙ진 S. mutansмқҳ м •лҹүм Ғ м–‘кіј DentocultВ®-SM strip mutansлӮҳ PCR кІ°кіј к°„мқҳ мң мқҳм Ғ м—°кҙҖм„ұмқ„ мң 추н•ҳкё°к°Җ м–ҙл Өмӣ лӢӨ. к·ёлҹ¬лҜҖлЎң S. mutansмқҳ м „мІҙм Ғмқё м–‘ мёЎм •мқ„ мң„н•ҙм„ң ліҙлӢӨ л§ҺмқҖ S. mutansм—җ лҢҖн•ң н•ӯмІҙ к°ңл°ң м—°кө¬к°Җ н•„мҡ”н•ҳл©° к·ём—җ л”°лқј лӢЁмқј н•ӯмІҙ лӘЁл‘җлҘј мқҙмҡ©н•ң S. mutansмқҳ мёЎм • мӢӨн—ҳлҸ„ мҲҳн–үлҗҳм–ҙм ём•ј н• кІғмңјлЎң ліҙмқёлӢӨ.
лҳҗн•ң нғҖм•Ў мұ„м·Ё мӢң кө¬к°•мқҳ нҷҳкІҪ мҡ”мқёмқ„ мғқк°Ғн•ҙ ліј мҲҳ мһҲлӢӨ. л§Ңмқј м№ҳм•„мҡ°мӢқмҰқмқҳ л°ңмғқм—җ лӢЁм§Җ м№ҳл©ҙм„ёк· л§үмқ„ нҳ•м„ұн• мҲҳ мһҲлҠ” лҜёмғқл¬ј мҡ”мқёл§Ңмқҙ к·ё мӣҗмқёмқҙ лҗңлӢӨл©ҙ н•ң к°Җм§Җ кІҖмӮ¬л§ҢмңјлЎң 충분нһҲ к°ңк°ңмқёмқҳ мҡ°мӢқ л°ңмғқмқ„ мҳҲкІ¬н•ҳкі мҳҲл°©н• мҲҳк°Җ мһҲкІ мңјлӮҳ, лҜёмғқл¬ј мҡ”мқё мқҙмҷём—җлҸ„ лӢӨлҘё мҲҳл§ҺмқҖ мҡ”мқёл“Өмқҙ ліөн•©м ҒмңјлЎң мғҒнҳёмһ‘мҡ©мқ„ мқјмңјнӮӨлҠ” кө¬к°• нҷҳкІҪл“ӨлЎң мқён•ҙ, ліё мӢӨн—ҳм—җм„ңлҠ” м•һм„ң м–ёкёүн•ң кІғ мқҙмҷём—җлҠ” кө°мқ„ лӮҳлҲ„м–ҙ мЎ°мӮ¬н•ң кІғм—җ лҢҖн•ҳм—¬ нҒ° мқҳлҜё мһҲлҠ” кІ°кіјлҘј лҸ„м¶ңн•ҳм§Җ лӘ»н–ҲлӢӨ. м—°кө¬лҢҖмғҒмһҗл“Өмқҳ нғҖм•Ў мұ„м·Ё м „, кө¬лӮҙ мЎ°кұҙмқ„ лҸҷмқјн•ҳкІҢ м„Өм •н•ҳкё° мң„н•ҙ 칫мҶ”м§Ҳмқ„ м ңн•ңн•ҳмҳҖмңјлӮҳ, к·ё мқҙмҷёмқҳ мЎ°кұҙл“ӨмқҖ нҶөм ңн•ҳкұ°лӮҳ мЎ°м Ҳн•ҳм§Җ лӘ»н–ҲлӢӨ. лҳҗн•ң 3кө°мқҳ кІҪмҡ° лҚ” мң мқҳн•ң мғҒкҙҖм„ұмқҙ кҙҖм°°лҗҳм§Җ м•ҠмқҖ кІғмқҖ м„ұмқёмқҖ мқјм°Ё мҡ°мӢқліҙлӢӨлҠ” мқҙм°Ё мҡ°мӢқмқҙ лҚ” л§Һм•„ мҡ°мӢқл°ңлі‘ кё°м „мқҙ м•„мқҙл“ӨліҙлӢӨ лҚ” ліөмһЎн•ҳкі , лӢҙл°°лӮҳ ліөмҡ© м•Ҫн’Ҳ, к·ёлҰ¬кі нғҖм•Ў нқҗлҰ„ л“ұмқҙ м„ұмқёмқҳ кө¬к°• нҷҳкІҪм—җ лҚ” мҳҒн–Ҙмқ„ мЈјм—Ҳкё° л•Ңл¬ёмқҙлқј 여겨진лӢӨ[30]. мұ„м·Ё мӢңк°„м—җ л”°лқј S. mutansмқҳ мҲҳк°Җ лӢ¬лһҗлӢӨлҠ” м—°кө¬лҸ„ мһҲм–ҙ мқҙ лҳҗн•ң м ңн•ңлҗҳм–ҙм•ј н•ҳлҠ” мҡ”мқёмңјлЎң мӮ¬лЈҢлҗңлӢӨ. м—¬лҹ¬ м—°кө¬л“Өм—җм„ң м№ҳм•„мҡ°мӢқмҰқмқҳ л°ңмғқмқ„ мң„н•ҙм„ңлҠ” лҜёмғқл¬ј, мӢқмқҙ, мӢңк°„лҝҗл§Ң м•„лӢҲлқј, мӮ¬нҡҢ, н–үлҸҷ мҡ”мқё к°ҷмқҖ нҷҳкІҪ л°Ҹ кө¬к°•кІҖмӮ¬кІ°кіј л“ұмқҳ лӢӨм–‘н•ң мҡ”мқёмқҙ кі л Өлҗҳм–ҙм•ј н•ңлӢӨкі мЈјмһҘн•ҳмҳҖлӢӨ[31]. м№ҳм•„мҡ°мӢқмҰқмқ„ мҳҲмёЎн•ҳлҠ” лҚ° мһҲм–ҙ лҜёмғқл¬ј мҡ”мқёмқҙ к°ҖмһҘ мҳҒн–Ҙл Ҙ мһҲлҠ” мқёмһҗмқҙкё°лҠ” н•ҳлӮҳ, лӢӨлҘё мҡ”мқёл“Өм—җ мқҳн•ҙ м№ҳм•„мҡ°мӢқмҰқмқҳ м •лҸ„к°Җ к°Җк°җлҗ мҲҳ мһҲлҠ” кІғмқҙкё°м—җ м°Ёнӣ„ лӢЁмқјнҒҙлЎ н•ӯмІҙлҘј мқҙмҡ©н•ң S. mutansмқҳ мёЎм •лҹүкіј DMFTмҷҖмқҳ мң мқҳм Ғ м—°кҙҖм„ұмқ„ м°ҫкё° мң„н•ң мӢӨн—ҳм—җм„ңлҠ” м—°кө¬ лҢҖмғҒмһҗл“Өмқҳ нҷҳкІҪм Ғ мЎ°кұҙмқ„ м„ёл°Җн•ң мЎ°кұҙмңјлЎң м ңн•ңн•ҳкұ°лӮҳ, м„Өл¬ём§Җ л“ұмңјлЎң лӢӨлҘё мҡ”мқёл“Өмқ„ мЎ°мӮ¬н•ң м—°кө¬лҘј мҲҳн–үн•ҳм—¬м•ј н• кІғмқҙлӢӨ.
к·ёлҹ¬лӮҳ ліё мӢӨн—ҳм—җм„ңлҠ” мқҙлҹ¬н•ң лӢӨм–‘н•ң мЎ°кұҙл“Өмқ„ мЎ°м Ҳн•ҳм§Җ м•Ҡм•ҳмқҢм—җлҸ„ л¶Ҳкө¬н•ҳкі PCRмқ„ нҶөн•ң S. mutansмқҳ мёЎм •м—җм„ң к·ё мёЎм • лҠҘл Ҙмқҙ DentocultВ®-SM strip mutansлҘј мқҙмҡ©н•ң кІғліҙлӢӨ 11% лҚ” лҶ’мқҖ кІғмңјлЎң лӮҳнғҖлӮ¬мңјл©° лӢЁмқјнҒҙлЎ н•ӯмІҙлҘј мқҙмҡ©н•ҳм—¬ мёЎм •н•ң кІҪмҡ°, log2лЎң к·ё к°’мқ„ лӮҳнғҖлғҲмқ„ л•Ң к°ҖмһҘ лӮ®мқҖ к°’мқҖ 0.43мқҙм—Ҳкі к°ҖмһҘ лҶ’мқҖ к°’мқҖ 3.10мңјлЎң к°’мқҳ м°ЁмқҙлҠ” мһҲм—ҲмңјлӮҳ S. mutansлҘј 100% кІҖм¶ңн•ҳмҳҖлӢӨ.
л”°лқјм„ң ліё м—°кө¬м—җм„ң м–»м–ҙ진 кІ°кіјлҘј нҶ лҢҖлЎң н•ҳм—¬, лҚ” нҶөм ңлҗң мЎ°кұҙн•ҳм—җ мӢӨн—ҳмқҙ 진н–үлҗңлӢӨл©ҙ ліҙлӢӨ лӮҳмқҖ мӢӨн—ҳ кІ°кіјлҘј м–»мқ„ мҲҳ мһҲмқ„ кІғмқҙлқј м—¬кІЁм§Җл©° м°Ёнӣ„ ліҙк°• мӢӨн—ҳмқ„ нҶөн•ҙ лӢЁмқјн•ӯмІҙлҘј мқҙмҡ©н•ң м№ҳм•„мҡ°мӢқ мҳҲл°©м—°кө¬мҷҖ нҳ„ м ңн’ҲліҙлӢӨ лҚ” нҷңмҡ©лҸ„ лҶ’мқҖ S. mutans мёЎм • м ңн’Ҳ к°ңл°ңмқ„ мң„н•ң м—°кө¬лҘј мҲҳн–үн• мҲҳ мһҲмқ„ кІғмқҙлӢӨ.
м—°кө¬ лҢҖмғҒмқё м„ё кө° лӘЁл‘җм—җм„ң лӢЁмқјнҒҙлЎ н•ӯмІҙлҘј мӮ¬мҡ©н•ң нғҖм•Ў лӮҙ S. mutansмқҳ кІҖм¶ңк°’кіј м—°кө¬ лҢҖмғҒл“Өмқҳ DMFT, DentocultВ®- SM strip mutansлҘј мқҙмҡ©н•ң colony density (CFU/mL), к·ёлҰ¬кі PCRмқ„ мқҙмҡ©н•ң S. mutansмҷҖ S. sobrinus мЎҙмһ¬м—¬л¶Җ мӢӨн—ҳмқ„ мҲҳн–үн•ң кІ°кіј, мҙқ 97лӘ…мқҳ н”јмӢӨн—ҳмһҗ мӨ‘ DMFTк°Җ 0мқё лҢҖмғҒмқҖ 8лӘ…мңјлЎң мқҙ мӨ‘ 18%м—җм„ң S. mutansк°Җ кІҖм¶ңлҗҳм—Ҳкі 50%м—җм„ң S. sobrinusк°Җ кІҖм¶ңлҗҳм—Ҳмңјл©° 32%м—җм„ңлҠ” л‘ҳ лӢӨ кІҖм¶ңлҗҳм§Җ м•ҠмқҢмңјлЎңм„ң, S. sobrinusк°Җ м№ҳм•„мҡ°мӢқ нҳ•м„ұм—җ нҒ° мҳҒн–Ҙмқ„ мЈјм§Җ м•ҠлҠ” мҡ”мқёмһ„мқҙ кҙҖм°°лҗҳм—ҲлӢӨ. лҳҗн•ң S. mutansмқҳ лӢЁл°ұм§Ҳмқё gtf B, C, DмҷҖ Ag I/IIм—җ лҢҖн•ң лӢЁмқјнҒҙлЎ н•ӯмІҙл“Өмқ„ мқҙмҡ©н•ҳм—¬ S. mutansлҘј кІҖм¶ңн•ҳмҳҖмқ„ л•Ң к·ё кІҖм¶ң лҠҘл Ҙмқҙ DentocultВ®-SM strip mutansлӮҳ PCRліҙлӢӨ лӣ°м–ҙлӮЁмқ„ ліҙмҳҖлӢӨ. мқҙлҹ¬н•ң кІ°кіјл“Өмқ„ нҶ лҢҖлЎң ліё мӢӨн—ҳмқҖ, S. mutansлҠ” м№ҳм•„мҡ°мӢқ нҳ•м„ұм—җ мЈјмҡ” мӣҗмқёк· мңјлЎң S. mutansлҘј мҳҲмёЎн•ҳлҠ” кІғмқҙ м№ҳм•„мҡ°мӢқ мҳҲл°©мқ„ мң„н•ң м „м ңмЎ°кұҙмқҙ лҗ мҲҳ мһҲмңјл©° мқҙлҘј мң„н•ҙ мқҙ к· м—җ лҢҖн•ң кІҖм¶ң лҠҘл Ҙмқҙ лӣ°м–ҙлӮң S. mutansмқҳ Ag I/IIмҷҖ gtf B, C, Dм—җ лҢҖн•ң лӢЁмқјнҒҙлЎ н•ӯмІҙлҘј мқҙмҡ©н• мҲҳ мһҲлӢӨлҠ” кІғмқ„ ліҙм—¬мЈјм—ҲлӢӨ. лҳҗн•ң мқҙ лӢЁмқјнҒҙлЎ н•ӯмІҙл“Өмқ„ мқҙмҡ©н•ҳм—¬ S. mutans кІҖм¶ң м ңн’Ҳм—җ лҢҖн•ң к°ңл°ң м—°кө¬ к°ҖлҠҘм„ұмқ„ м ңмӢңн• мҲҳ мһҲмқ„ кІғмңјлЎң мғқк°ҒлҗңлӢӨ.
Fig.В 1.
Representative results from the electrophoresis of polymerase chain reaction using Streptococcus mutans and Streptococcus sobrinus in saliva samples of group 1. (A) Streptococcus mutans. (B) Streptococcus sobrinus. (M : marker, lane 1-31 : products of polymerase chain reaction of group 1).
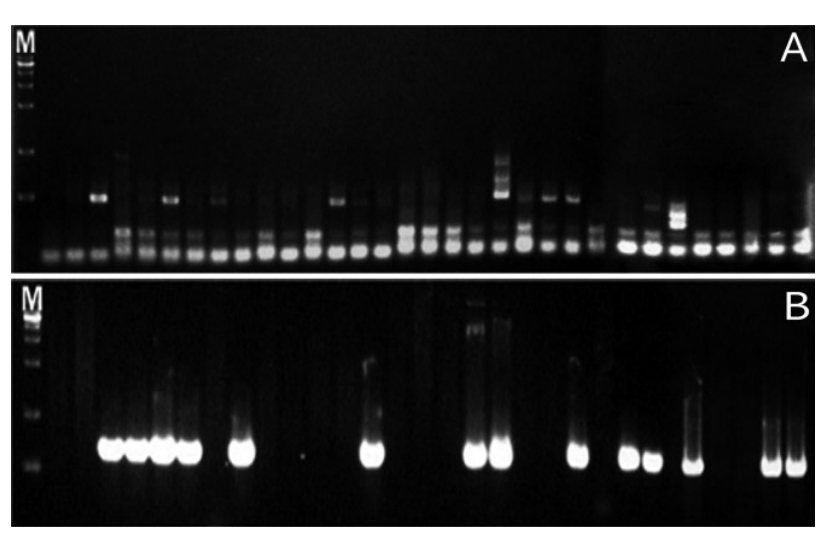
Fig.В 2.
Representative results from the electrophoresis of polymerase chain reaction using Streptococcus mutans and Streptococcus sobrinus in saliva samples of group 2. (A) Streptococcus mutans. (B) Streptococcus sobrinus. (M : marker, lane 1-25 : products of polymerase chain reaction of group 1).

Fig.В 3.
Representative results from the electrophoresis of polymerase chain reaction using Streptococcus mutans and Streptococcus sobrinus in saliva samples of group 3. (A) Streptococcus mutans. (B) Streptococcus sobrinus. (M : marker, lane 1-41 : products of polymerase chain reaction of group 1).
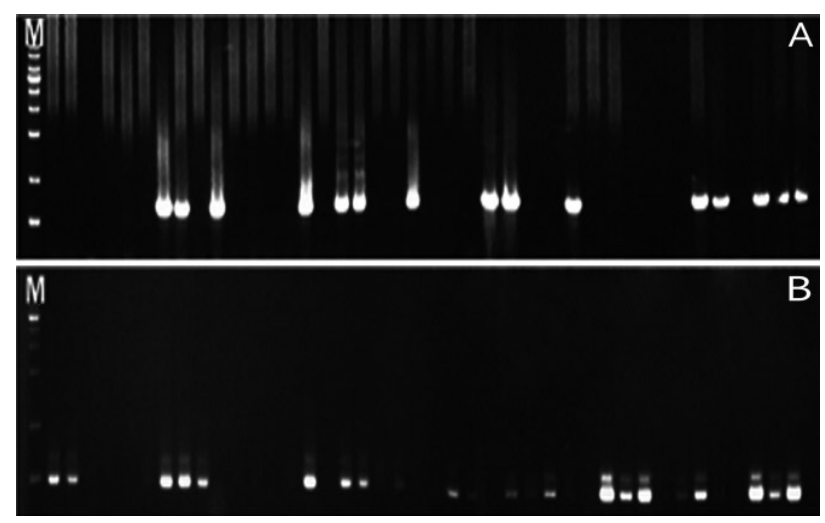
Fig.В 4.
Level of antibodies (A) ckAg I/II, (B) ckBN, (C) ckCN, (D) ckDN identified by enzyme-linked immunosorbent assay (ELISA) in saliva samples of group 1.

Fig.В 5.
Level of antibodies (A) ckAg I/II, (B) ckBN, (C) ckCN, (D) ckDN identified by enzyme-linked immunosorbent assay (ELISA) in saliva samples of group 2.
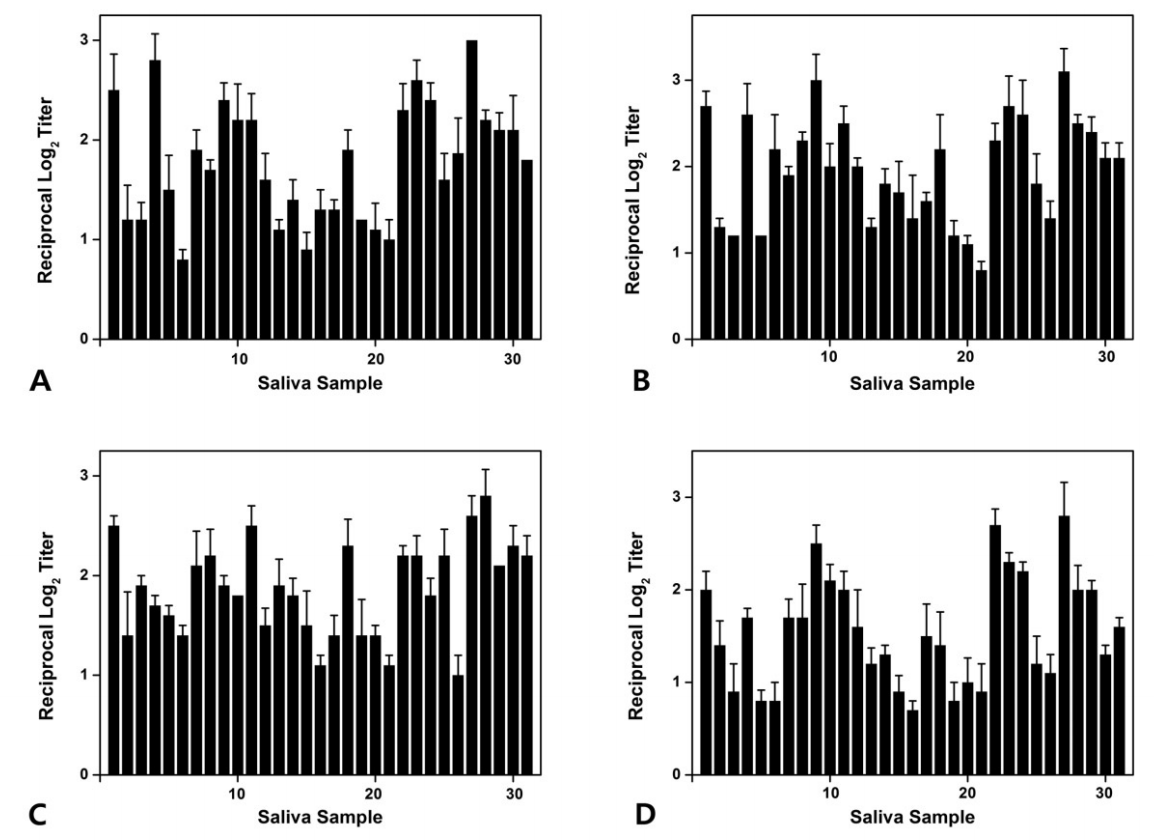
Fig.В 6.
Level of antibodies (A) ckAg I/II, (B) ckBN, (C) ckCN, (D) ckDN identified by enzyme-linked immunosorbent assay (ELISA) in saliva samples of group 3.
TableВ 1.
Caries risk and colony density of grades
| DentocultВ®-SM grade | Caries Risk | Colony Density (CFU/mL) |
|---|---|---|
| 0 | negative | CFU/mL < 104 |
| 1 | mild | 104 < CFU/mL < 105 |
| 2 | moderate | 105 < CFU/mL < 106 |
| 3 | severe | CFU/mL > 106 |
TableВ 2.
Distribution of the DMFT index
| N (%) | DMFT (Mean Вұ SD) | Range | p value | |
|---|---|---|---|---|
| Group 1 | 31 (32.0) | 5.16a Вұ 2.89 | 1.00 - 13.00 | |
| Group 2 | 25 (25.7) | 5.12a Вұ 4.06 | 0.00 - 13.00 | 0.002** |
| Group 3 | 41 (42.3) | 8.39b Вұ 5.20 | 0.00 - 19.00 | (p = 0.009**)вҖЎ |
| Total | 97 (100.0) | 6.52 Вұ 4.60 | 0.00 - 19.00 |
TableВ 3.
Distribution of colony density (CFU/mL) level of Streptococcus mutans
| Group 1 | Group 2 | Group 3 | Total | p value | |
|---|---|---|---|---|---|
| N (%) | N (%) | N (%) | N (%) | ||
| Grade 0 | 10 (32.3) | 11 (44.0) | 18 (43.9) | 39 (40.2) | |
| Grade 1 | 16 (51.6) | 11 (44.0) | 16 (39.0) | 43 (44.3) | 0.916 |
| Grade 2 | 4 (12.9) | 2 (8.0) | 6 (14.6) | 12 (12.4) | (p = 0.912)вҖ |
| Grade 3 | 1 (3.2) | 1 (4.0) | 1 (2.4) | 3 (3.1) |
TableВ 4.
Detection of Streptococcus mutans and Streptococcus sobrinus using polymerase chain reaction
| Group 1 | Group 2 | Group 3 | Total | p value | ||
|---|---|---|---|---|---|---|
| N (%) | N (%) | N (%) | N (%) | |||
| PCR | O | 12 (38.8) | 13 (52.0) | 25 (61.0) | 50 (51.5) | 0.022* |
| -SM | X | 19 (61.3) | 12 (48.0) | 16 (39.0) | 47 (48.5) | (p = 0.013*)вҖ |
| PCR | O | 13 (41.9) | 15 (60.0) | 15 (36.6) | 43 (44.3) | 0.169 |
| -SS | X | 18 (58.1) | 10 (40.0) | 26 (63.4) | 54 (55.7) | (p = 0.177)вҖ |
| PCR | O | 6 (19.4) | 7 (28.0) | 11 (26.8) | 24 (24.7) | 0.697 |
| -Both | X | 25 (80.6) | 18 (72.0) | 30 (73.2) | 73 (75.3) | (p = 0.726)вҖ |
TableВ 5.
level of monoclonal antibodies reacted with Streptococcus mutans in saliva samples
| Group 1 | Group 2 | Group 3 | Total | p value | |
|---|---|---|---|---|---|
| ckAg I/II | 1.78 Вұ 0.59 | 1.70 Вұ 0.41 | 1.65 Вұ 0.53 | 1.71 Вұ 0.52 | 0.595 (p = 0.693)вҖ |
| ckBN | 1.97 Вұ 0.61 | 1.82 Вұ 0.55 | 1.67 Вұ 0.61 | 1.80 Вұ 0.60 | 0.107 (p = 0.117)вҖ |
| ckCN | 1.86bВұ 0.47 | 1.57aВұ 0.48 | 1.44a Вұ 0.63 | 1.61 Вұ 0.57 | 0.005** (p = 0.003**)вҖ |
| ckDN | 1.55 Вұ 0.59 | 1.70 Вұ 0.55 | 1.44 Вұ 0.63 | 1.54 Вұ 0.60 | 0.225 (p = 0.180)вҖ |
References
1. Petersen PE : Challenges to improvement of oral health in the 21st century the approach of the WHO Global Oral Health Programme. Int Dent J, 54:329-343, 2004.


2. Korea National Oral Health Survey, 2012. Assessment service. Available from URL: http://www.google.co.kr/url?url=http://www.dibrary.net/jsp/download.jsp%3Ffile_id%3DFILE-00008155087&rct=j&frm=1&q=&esrc=s&sa=U&ei=zgZyVKOtLMSVmwXkyIG4CQ&ved=0CBMQFjAA&usg=AFQjCNHlhFCUrl38tP__gbB0uAwQvwUUNw (Accessed on November 23, 2014)
3. Keyes PH, Jordan HV : Factors influencing the initiation transmission and inhibition of dental caries. In: Mechanisms of Hard Tissue Destruction. Academy Press, NY, 261-283, 1963.
5. Marsh PD : Microbiological aspects of the chemical control of plaque and gingivitis. J Dent Res, 1431-1438, 1992.


6. AjdiДҮ D, McShan WM, McLaughlin RE, et al. : Genome sequence of Streptococcus mutans UA159, a cariogenic dental pathogen. Proc Natl Acad Sci USA, 99:14434-14439, 2002.



7. Jenkinson HF, Demuth DR : Structure, function and immunogenicity of streptococcal antigen I/II polypeptides. Mol Microbiol, 23:183-190, 1997.


8. Taubman MA, Nash DA : The scientific and public-health imperative for a vaccine against dental caries. Nat Rev Immunol, 6:555-63, 2006.


9. Rationale and Evidence for the International Caries Detection and Assessment System (ICDAS II). Assessment service. Available from URL:https://www.icdas.org/uploads/Rationale%20and%20Evidence%20ICDAS%20II%20September%2011-1.pdf (Accessed on November 23, 2014)
10. Köhler B, Andréen I, Jonsson B : The earlier the colonization by mutans streptococci, the higher the caries prevalence at 4 years of age. Oral Microbiol Immunol, 3:14-17, 1988.


11. Okada M, Soda Y, Hayashi F, et al. : PCR detection of Streptococcus mutans and S. sobrinus in dental plaque samples from Japanese pre-school children. J Med Microbiol, 51:443-447, 2002.


12. Okada M, Soda Y, Hayashi F, et al. : Longitudinal studies on dental caries incidence associated with Streptococcus mutans and Streptococcus sobrinus in pre-schoolchildren. J Med Microbiol, 54:661-665, 2005.


13. Jenkinson HF, Demuth DR : Structure, function and immunogenicity of streptococcal antigen I/II polypeptides. Mol Microbiol, 23:183-190, 1997.


14. Nakano K, Tsuji M, Nishimura K, et al. : Contribution of cell-surface protein antigen PAc of Streptococcus mutans to bacteremia. Microbes Infect, 8:114-121, 2006.


15. Brandtzaeg P : Overview of the mucosal immune system. Curr Top Microbiol Immunol, 146:13-25, 1989.


16. Rozen R, Bachrach G, Bronshtetyn M, et al. : The role of fructans on dental biofilm formation by Streptococcus sobrinus, Streptococcus mutans, Streptococcus gordonii and Actinomyces viscosus. FEMS Microbial Lett, 195:205-210, 2001.

17. Carlsson J : Microbial aspects of frequent intake of products with high sugar concentrations. Scand J Dent Res, 97:110-114, 1989.


18. Russell MW, Hajishengallis G, Childers NK, et al. : Secretory immunity in defense against cariogenic mutans streptococci. Caries Res, 33:4-15, 1999.


19. Taubman MA, Smith DJ : Significance of salivary antibody in dental disease. Ann N Y Acad Sci, 694:202-215, 1993.


20. Gregory RL, Michalek SM, Shechmeister IL, et al. : Function of anti-streptococcus mutans antibodies : anti-ribodomal antibodies inhibit acid production, growth, and glucose phosphotransferase activity. Infect Immun, 45:286-289, 1984.



21. Childers NK, Tong G, Mitchell S, et al. : A controlled clinical study of the effect of nasal immunization with a Streptococcus mutans antigen alone or incorporated into liposomes on induction of immune responses. Infect Immun, 67:618-623, 1999.



22. Liu C, Fan M, Bian Z, et al. : Effects of targeted fusion anti-caries DNA vaccine pGJA-P/VAX in rats with caries. Vaccine, 26:6685-6689, 2008.


23. Ma JKC, Hunjan M, Smith R, et al. : An investigation into the mechanism of protection by local passive immunization with monoclonal antibodies against Streptococcus mutans. Infect Immun, 58:3407-3414, 1990.



24. Shi W, Jewett A, Hume WR : Rapid and quantitative detection of Streptococcus mutans with speciesspecific monoclonal antibodies. Hybridoma, 17:365-371, 1998.


25. Wennerholm K, Emilson CG : Comparison of Saliva-Check Mutans and Saliva-Check IgA Mutans with the Cariogram for caries risk assessment. Eur J Oral Sci, 121:389-393, 2013.


26. Kim CS, Kim JG, Yang YM, et al. : Detection of salivary Streptococcus mutans levels using monoclonal antibodies. J Korean Acad Pediatr Dent, 37:186-192, 2010.
27. Ikebe K, Imazato S, Izutani N, et al. : Association of salivary Streptococcus mutans levels determined by rapid detection system using monoclonal antibodies with prevalence of root surface caries. Am J Dent, 21:283-287, 2008.

28. Cho PK, Park SS : A study on analysis of the Relationship Oral bacteria to dental caries experience in disabled students: in Gyeong-nam. J Korean Soc Dent Hyg, 8:115-125, 2008.
29. Chia JS, Lin SW, Yang CS, et al. : Antigenicity of a synthetic peptide from glucosyltransferases of Streptococcus mutans in humans. Infect Immun, 65:1126-1130, 1997.



- TOOLS
-
METRICS

-
- 1 Crossref
- 0 Scopus
- 8,274 View
- 96 Download
- Related articles



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print